Composizione, struttura e dinamiche digestive del latte proveniente da diverse specie animali
Confronto tra le composizioni del latte bovino e non bovino
Percentuali delle principali proteine
Caratteristiche delle micelle di caseina
Potenziale ipoallergenico dei latti di origine non bovina
Composizione del grasso del latte
Dimensione nei globuli di grasso del latte
Prove di coagulazione del latte
Caratteristiche del coagulo e gli effetti del latte umano e bovino
Digestione del latte proveniente da specie diverse
Influenza dell’insieme proteico sulla digestione dei grassi – la matrice del latte intero
Digestione gastroenterica dei grassi
Conclusioni e suggerimenti per la ricerca futura
Background
L’industria dei prodotti lattiero-caseari si sta sempre più diversificando, con l’introduzione di latte e latticini provenienti da specie da latte diverse dai bovini. L’interesse per le varie tipologie di latte non di origine bovina è aumentato perché esistono diversi report che contengono aneddoti sui benefici nutrizionali di questi latti, sul fatto che alcuni individui meglio tollerano e digeriscono alcune di queste tipologie di latte rispetto al latte bovino e sul fatto che questi latti non di origine bovina potrebbero avere certe caratteristiche in comune con il latte umano. Pertanto, si ritiene che le varie tipologie di latte non di origine bovina possano essere impiegate per l’alimentazione di neonati, bambini ed anziani e per la realizzazione di prodotti specifici con migliori profili nutrizionali. Tuttavia, esistono pochissime informazioni scientifiche e conoscenze sulle modalità di digestione dei latti diversi da quello bovino.
Scopo e approccio
Sono state analizzate le caratteristiche generali di alcune tipologie di latte diverse da quello bovino, in particolare il profilo proteico, la composizione dei grassi, la digeribilità e l’eventualità che possano essere ipoallergenici rispetto al latte umano e bovino. Nel dettaglio sono stati esaminati i processi di coagulazione delle diverse tipologie di latte nello stomaco ed il loro impatto sulla digestione delle proteine e dei grassi.
Principali risultati e conclusioni
Il latte proveniente da specie diverse varia per composizione, struttura e proprietà fisico-chimiche. Questo può essere un fattore chiave capace di influenzare i loro diversi processi di digestione. La cagliata che si forma nello stomaco durante la digestione gastrica di alcune tipologie di latte non di origine bovina viene considerata relativamente più morbida di quella che si forma dal latte bovino, e questo aspetto si ritiene che possa contribuire al grado in cui i latti non bovini possano essere più facilmente digeriti o tollerati. È probabile che le percentuali di rilascio delle proteine e dei grassi nell’intestino tenue siano collegate alla macro ed alla microstruttura della cagliata formatasi nello stomaco, che a sua volta è influenzata da fattori come la composizione della caseina, la distribuzione dei globuli di grasso e le dimensioni della micella di caseina e dal rapporto grassi/proteine. Tuttavia, poiché non abbiamo a disposizione informazioni sul comportamento di coagulazione dei latti diversi da quello bovino all’interno dello stomaco umano, sono necessari approfonditi studi scientifici per comprendere l’impatto delle differenze di composizione e di struttura sulle dinamiche digestive del latte proveniente da specie diverse.
Parole chiave: latte, composizione, digestione, cagliata, proteine, grasso, struttura, stomaco.
Introduzione
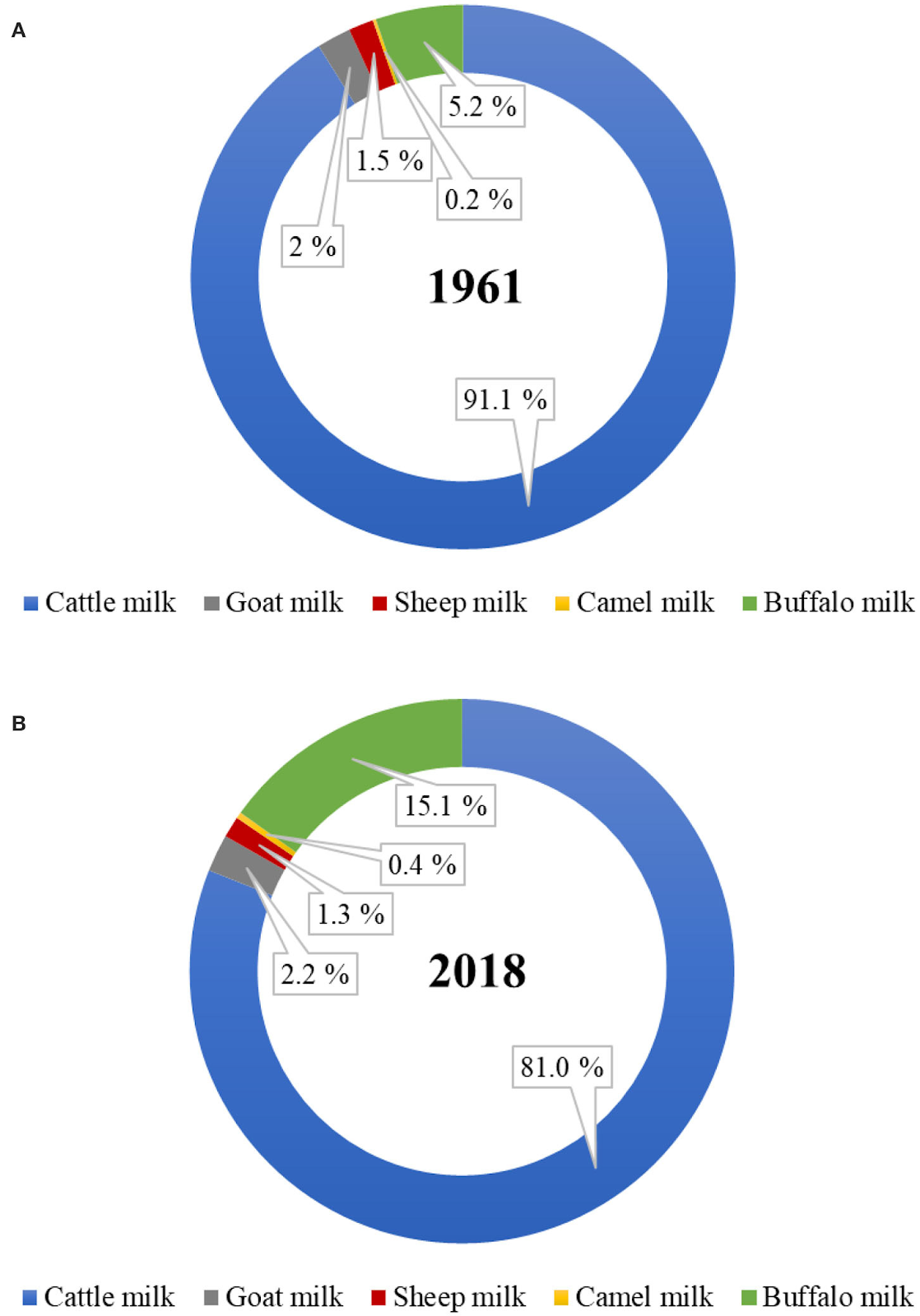
Il latte si è evoluto nel tempo per soddisfare le esigenze nutrizionali e fisiologiche del neonato. Viene quindi considerato un alimento di alta qualità, dal punto di vista nutrizionale. Si sa che, sin dalla preistoria, gli esseri umani hanno consumato latte bovino (Bos taurus, vacca) e di altre specie (come capra e pecora) come parte integrante della loro dieta (1,2). Essendo una fonte di nutrimento conveniente, il latte bovino è la tipologia di latte più consumata al mondo vista la sua ampia disponibilità ed i grandi volumi prodotti. Le tipologie di latte non di origine bovina sono importanti dal punto di vista nutrizionale per le persone che vivono nei paesi in via di sviluppo ed in quelle aree geografiche dove il clima naturale non è adatto alla sopravvivenza dei bovini da latte (3,4). Alcuni esempi sono il latte di bufala in Asia, il latte di pecora in Europa e nel bacino del Mediterraneo (compreso il Medio Oriente), il latte di cammello (detto “l’oro bianco” del deserto) in Africa, il latte di capra (“il bestiame dei poveri”) in Africa ed in Asia meridionale, il latte di cavalla nelle steppe dell’Asia centrale, il latte di yak sull’altopiano tibetano, il latte di renna nella Scandinavia settentrionale, il latte di bue muschiato nell’Artico ed il latte di mithun nelle regioni collinari del subcontinente indiano (3,5). Della produzione mondiale di latte totale, la percentuale del latte non bovino è aumentata, passando dal 9% circa nel 1961 al 19% nel 2018 (Figura 1). Se parliamo della produzione globale di latte non bovino, il latte di bufala è quasi triplicato, il latte di cammello è quasi raddoppiato ed il latte di capra è leggermente aumentato durante questo periodo. Non sono disponibili statistiche mondiali sulla quantità di latte prodotto da altre specie come yak, cavallo, asino, cervo, bue muschiato e lama. Gran parte della produzione di latte non bovino rimane non dichiarata ufficialmente, data la scarsa conoscenza delle quantità che vengono consumate localmente a casa del contadino o vendute direttamente dagli allevatori alla popolazione locale, specialmente nei paesi in via di sviluppo (6,7). Nei sistemi di allevamento basati su animali diversi dalle vacche, l’introduzione del latte come prodotto da vendere aggiunge valore ed aiuta gli allevatori a far fronte alle fluttuazioni dei prezzi di carne, pellame e lana.
FIGURA 1. Percentuale del latte di origine bovina e non prodotto a livello globale negli anni (A) 1961 e (B) 2018. (fonte: FAOstat, Marzo 2020).
La mungitura di bufale, capre, pecore e cammelle rappresenta una pratica ben organizzata in molte parti del mondo che sta guadagnando popolarità e che si sta rivelando redditizio per coloro che l’hanno già implementato. Recentemente, la Nuova Zelanda ha messo a punto un sistema di allevamento di cervi rossi. Anche le grandi aziende lattiero-casearie e le piccole e medie imprese (PMI) specializzate sono interessate ad utilizzare il latte non proveniente da vacche come strategia di diversificazione per la loro gamma di prodotti. Le norme per garantire una produzione sicura di latte bovino (e di prodotti lattiero-caseari) sono ben definiti nella maggior parte del mondo. Tuttavia, gli stessi estremi normativi potrebbero non essere validi per il latte e i latticini prodotti con latte diverso da quello di vacca. Pertanto, è necessario porre maggiore attenzione sugli standard normativi specie-specifici, per garantire la sicurezza e la qualità delle diverse tipologie di latte per il consumo umano (8-11). Inoltre, le aziende che producono latte non da vacche dovranno comprendere l’importanza del rispetto delle leggi religiose sugli alimenti (come Kosher o Halal) al fine di ottenere l’accettazione dei loro prodotti da parte dei vari gruppi di consumatori (12). Negli ultimi anni, la produzione di latte e la realizzazione di prodotti con altre tipologie di latte animale sono aumentate perché si è percepito che il numero dei bovini sta raggiungendo il limite dal punto di vista della salvaguardia ambientale. Si ritiene inoltre che i latti non bovini abbiano determinati benefici nutrizionali rispetto ad esso. Ad esempio, il latte di capra, pecora, cammello, cavallo ed asina viene considerato relativamente più facile da digerire, ipoallergenico e più simile al latte umano rispetto al latte bovino (4, 13, 14). Inoltre, i latti non bovini possono essere utilizzati per realizzare specifici prodotti lattiero-caseari con elevato valore nutrizionale e molto importanti sia a livello internazionale che regionale (culturale locale), come formaggio, yogurt, burro, burro chiarificato, gelato, latte fermentato, bevande a base di latte con probiotici, compresse di latte e latte artificiale per neonati (3,15,16). Tuttavia, non abbiamo a nostra disposizione molte informazioni scientifiche sui benefici nutrizionali dei latti diversi da quello di vacca. Inoltre, vi è una significativa lacuna nella conoscenza dettagliata delle loro composizioni, in particolare quando si parla di componenti minori e di strutture proteiche e lipidiche presenti in questi latti.
Confronto tra le composizioni del latte bovino e non bovino
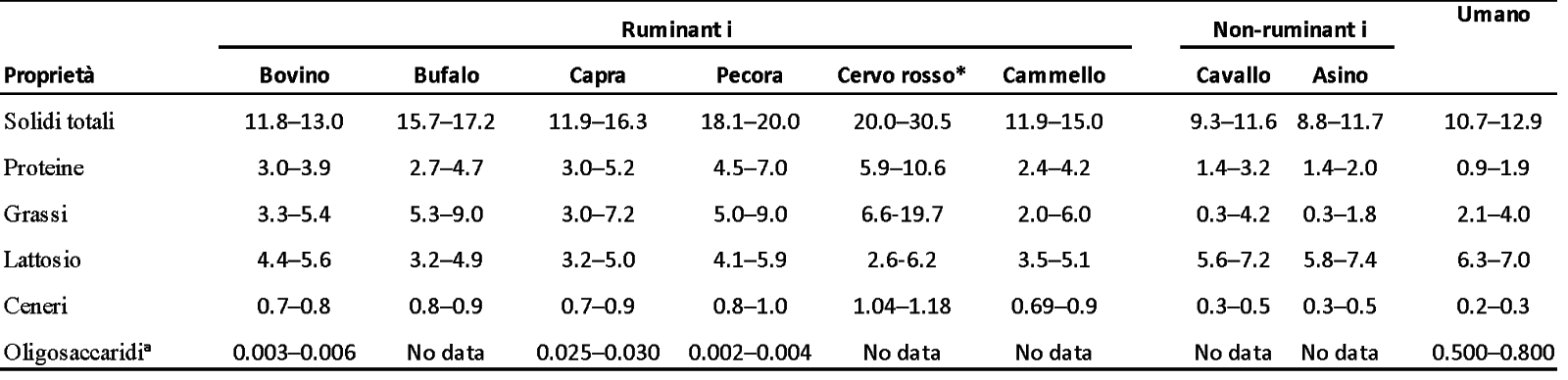
Il confronto tra le composizioni del latte ottenuto da specie diverse è stato ampiamente rivisto in studi precedenti (5, 17-19). Il latte proveniente da specie diverse varia nella sua composizione (Tabella 1). Proteine, grassi, lattosio e minerali sono le 4 componenti principali di tutti i tipi di latte, indipendentemente dalla specie (18); la composizione del latte all’interno di una stessa specie varia notevolmente a causa di vari fattori, come razza, stadio di lattazione, intervallo di mungitura, tipo di dieta somministrata e clima (7, 19). Ad esempio, Li et al. (26) hanno recentemente riportato che la fase della lattazione è un fattore chiave responsabile delle differenze nelle proprietà fisico-chimiche e nella composizione del latte di vacca in un sistema di allevamento con parto stagionale in Nuova Zelanda. I latti derivati dai monogastrici, come quelli di cavalla ed asina, sono in qualche modo simili al latte umano (in termini di contenuto di proteine, lattosio e ceneri), rispetto al latte delle vacche ed a quello di altri ruminanti (Tabella 1). I latti dei ruminanti hanno un contenuto più elevato di proteine e grassi rispetto al latte umano e ad altri latti non prodotti da ruminanti. Il latte umano contiene quantità molto più elevate di oligosaccaridi totali derivati dal lattosio rispetto al latte di altre specie (Tabella 1). Inoltre è risaputo che il latte di capra ha un contenuto di oligosaccaridi relativamente più elevato e la sua composizione viene considerata più simile a quella del latte umano (27, 28).
Tabella 1 Composizione generale (g 100 ml-1) del latte proveniente da specie diverse di mammiferi
#) Fonte: Adattato e modificato da Claeys et al. (19) e Crowley et al. (13).
*) Dati basati sui valori minimi e massimi ritrovati in letteratura per le diverse specie di cervo rosso; potrebbe includere dati provenienti dalle diverse fasi della lattazione (20-24).
a) Valori ricavati da Martinez-Farez et al. (25).
Percentuali delle principali proteine
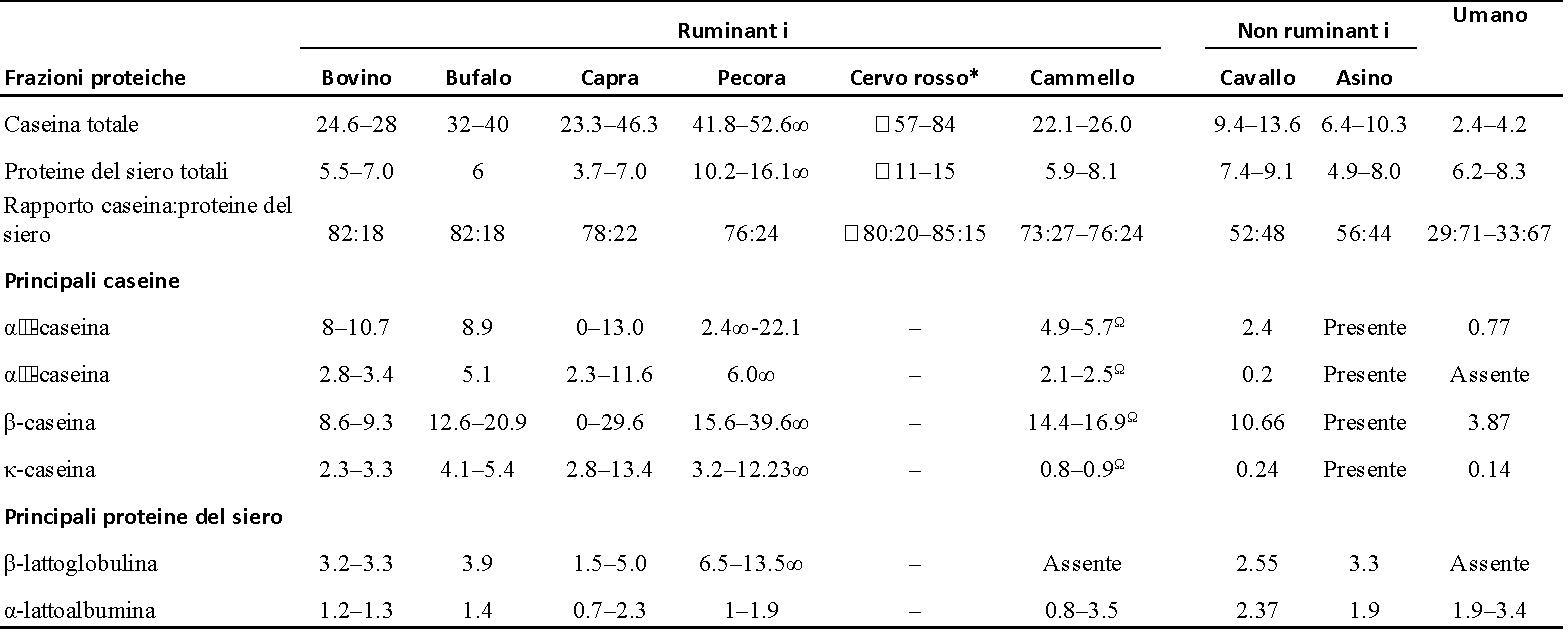
Rispetto al latte di vacca ed a quello di altri ruminanti, il latte di cavalla e d’asina hanno un basso rapporto caseina/proteine del siero di latte, più simile a quello del latte umano. Tra i latti dei ruminanti, il latte di capra, di pecora e di cammella hanno un rapporto caseina/proteine del siero di latte più basso ed un rapporto β-caseina/αs-caseina relativamente più alto rispetto al latte di bovino (Tabella 2). Pertanto, questi latti non bovini rappresentano un’alternativa interessante come potenziale ingrediente naturale per il latte artificiale (13); si è visto che un rapporto caseina/proteine del siero di latte più basso (cioè una percentuale maggiore di proteine del siero di latte) è più desiderabile poiché favorisce una digestione più rapida delle proteine presenti nel latte artificiale rispetto a quanto succede in caso di una composizione proteica dove domina la caseina (31, 32). Poiché il latte umano ha il più basso rapporto caseina/proteine del siero di latte, ha un elevato rapporto β-caseina/αs-caseina e non contiene β-lattoglobulina (Tabella 2), il latte di altre specie con proprietà simili ad esso è di grande interesse per il consumatore e per l’industria lattiero-casearia per poter sviluppare dei latticini specifici, non soltanto per i lattanti ma anche per persone di altre fasce d’età. La β-lattoglobulina è considerata uno dei principali allergeni responsabili della comparsa dell’allergia al latte bovino nei bambini (33). Pertanto, il latte di quelle specie animali che risulti essere privo di β-lattoglobulina (o con un rapporto β-lattoglobulina/α-lattoalbumina più basso) è molto interessante per il consumo umano. Il latte di cammella, come il latte umano, non contiene β-lattoglobulina (34, 35) o essa può essere presente in tracce in forme diverse (36-38). Anche il latte di lama non contiene β-lattoglobulina (5, 39), ma sono disponibili poche informazioni dettagliate sulla sua composizione proteica.
Caratteristiche delle micelle di caseina
Le singole caseine (αs1-, αs2-, β- e κ-caseina) sono presenti in tutti i latti come particelle autoassemblate sotto forma di “micelle di caseina” (40). La struttura fondamentale delle micelle di caseina nel latte di molte specie non è stata studiata in dettaglio, ad eccezione del latte di vacca. Recentemente, Ingham et al. (41) hanno utilizzato la diffusione di raggi X a piccolo angolo ed hanno riferito che le strutture interne delle micelle di caseina del latte di bovini, caprini e ovini avevano forti somiglianze e solo lievi differenze, che potrebbero essere dovute a differenze nella composizione della caseina, nell’idratazione e nelle proprietà fisico-chimiche. A parte le differenze nelle percentuali delle diverse caseine (Tabella 2), le micelle di caseina nel latte delle diverse specie differiscono per dimensioni, idratazione e mineralizzazione (Tabella 3). Tra tutti i latti dei mammiferi, le micelle di caseina presenti nel latte umano hanno il diametro più piccolo. Le dimensioni delle micelle di caseina del latte di capra, pecora, cervo, cammella e cavalla sono maggiori rispetto a quelle del latte umano e bovino (Tabella 3). Sood et al. (53) hanno riportato che la perdita di calcio dalle micelle di caseina del latte scremato (quando dializzate contro lo stesso campione di latte scremato contenente acido etilendiamminotetraacetico, EDTA) causava una maggiore idratazione (o rigonfiamento) delle micelle stesse. Sulla base di ciò, si è ipotizzato che il livello di idratazione delle micelle di caseina fosse correlato negativamente con la mineralizzazione delle micelle (54), cioè quando la mineralizzazione della micella di caseina aumenta, il suo grado di idratazione diminuisce. Pertanto, la minore idratazione delle micelle di caseina contenute nel latte di capra e di pecora veniva correlata alla sua maggiore mineralizzazione rispetto a quella delle micelle di caseina del latte di bovino (55, 56). Analogamente, le micelle di caseina presenti nel latte di bufala (50) e nel latte d’asina (51) sono ritenute meno idratate e più mineralizzate rispetto a quelle presenti nel latte di vacca. Va detto che esiste un alto grado di variabilità nei risultati riportati sulle caratteristiche delle micelle di caseina all’interno della stessa specie, cosa che potrebbe essere dovuta a differenze nelle metodiche analitiche utilizzate. Inoltre, anche differenze relative alla razza, alle varianti genetiche ed ai siti di fosforilazione delle caseine possono andare ad aggiungersi alla variabilità delle caratteristiche delle micelle di caseina all’interno e tra le diverse specie (13).
TABELLA 2. Profilo proteico (g L-1) del latte proveniente da specie diverse di mammiferi #.
#) Fonte: Adattato e modificato da Claeys et al. (19) e Crowley et al. (13).
*) Valori (g kg -1) derivati da Arman et al. (20) e dalle analisi SDS-PAGE di nostri lavori precedenti. Non ci sono dati sufficienti sul latte di cervo rosso in letteratura per ricavare dei valori approssimativi.
a) Valori ricavati da Kappeler (30).
∞) Valori (g Kg-1) ricavati dall’analisi SDS-PAGE di nostri lavori precedenti.
TABELLA 3. Caratteristiche della caseina del latte proveniente da specie diverse di mammiferi #.
#) Fonte: Adattato e modificato da claeys et al. (19).
I valori ottenuti da altri riferimenti sono indicati dalle lettere maiuscole: A, Roy et al. (29); B, Nguyen et al. (42), Pierre et al. (43), e Pierre et al. (44); C, Roy et al. (29); D, Dalgleish (45), Wang et al. (46), e Dewan et al. (47); E, Pellegrini et al. (48); F, Remeuf et al. (49); G, Ahmad et al. (50); H, Luo et al. (51); I, Beaucher et al. (52)
Composizione del grasso del latte
Rispetto al grasso del latte di altre specie (in particolare dei ruminanti), il grasso del latte umano contiene percentuali minori di acidi grassi saturi, percentuali maggiori di acidi grassi monoinsaturi e acidi grassi polinsaturi, un rapporto più elevato tra acidi grassi Ω-6 e Ω-3 e più alti livelli di colesterolo (Tabella 4). In generale, il latte di cavallo e d’asina contiene percentuali inferiori di acidi grassi saturi e percentuali maggiori di acidi grassi polinsaturi rispetto al latte dei ruminanti. Al contrario, i latti dei ruminanti contengono percentuali più elevate di acidi grassi monoinsaturi, un rapporto più elevato di acidi grassi Ω-6/Ω-3 e un maggior contenuto di colesterolo rispetto al latte di cavallo e d’asina (Tabella 4). Il contenuto di acido linoleico coniugato è simile nel latte umano e in quello dei ruminanti, ma è più basso in quello delle altre specie (Tabella 4). I grassi presenti nel latte di pecora e di capra sono rappresentati maggiormente da triacilgliceroli (TAG) a corta catena (responsabili del caratteristico sapore di questi latti) ed a media catena; allo stesso modo, il grasso contenuto nel latte di bufala contiene percentuali più elevate di TAG a catena media rispetto al latte di bovino, che invece ha percentuali maggiori di TAG a catena lunga (57-60). Rispetto al latte bovino, il latte di cammello contiene una percentuale maggiore di acidi grassi a lunga catena e una percentuale inferiore di acidi grassi a catena corta (61). I dati sulla composizione dei grassi del latte di cervo rosso sono scarsi, ma si ritiene che questo latte contenga il 5-10% in meno di acidi grassi insaturi e percentuali maggiori di acidi grassi a catena più corta e saturi rispetto al latte bovino (21). Queste differenze possono essere responsabili dei diversi comportamenti digestivi del grasso del latte nelle diverse specie, dato che i TAG a catena corta o media vengono più efficientemente idrolizzati dalle lipasi (62, 63). Gli acidi grassi saturi a lunga catena liberi, come l’acido palmitico (C16: 0), non sono considerati assorbibili in maniera efficiente dal corpo poiché formano saponi insolubili con il calcio nell’intestino tenue (64, 65). In questo contesto, si ritiene che la struttura del TAG svolga un ruolo chiave. La maggior parte dell’acido palmitico a lunga catena (C16:0) presente nel latte umano (>70%) si trova in posizione sn-2 della struttura del TAG; questa posizione è considerata idonea per la digestione e l’assorbimento di questo acido grasso e di altri nutrienti (18, 62, 66). German e Dillard (64) hanno affermato che la posizione degli acidi grassi saturi, come l’acido palmitico a lunga catena in posizione sn-2 dei TAG, rende sia gli acidi grassi in posizione sn-1 che quelli in posizione sn-3 facilmente idrolizzabili dalle lipasi pancreatiche in acidi grassi liberi, e produce sn-2 monoacilgliceroli, che vengono facilmente assorbiti nell’intestino tenue; questo fa si che anche il calcio contenuto nel latte diventi completamente disponibile ed assorbibile. Il latte d’asina ha la percentuale di acido palmitico in posizione sn-2 (cioè 54%) più vicina a quella del latte umano (74%) (Tabella 4). Pertanto, la struttura modificata dei TAG nel latte proveniente da altre specie potrebbe aiutarci ad ottenere migliori profili di digestione dei grassi del latte; questa potrebbe essere un’area di interesse per studi futuri.
TABELLA 4. Profilo degli acidi grassi (% degli acidi grassi totali) e del contenuto di colesterolo del latte proveniente da specie diverse di mammiferi#.
#) Fonte: Adattato e modificato da Claeys et al. (19) e da Crowley et al. (13).
SFA, acidi grassi saturi; MUFA, acidi grassi monoinsaturi; PUFA, acidi grassi polinsaturi; CLA, acido linoleico coniugato; C16:0, acido palmitico in posizione sn-2 dei TAG del latte.
Dimensione nei globuli di grasso del latte
Nel latte di tutte le specie il grasso è presente sotto forma di piccole goccioline sferiche, dette globuli, il cui diametro varia da 0.2 a 15μm (67). La dimensione di questi globuli di grasso varia nel latte di specie diverse; il latte di capra, pecora, cammello ed equino (cavalla e asina) ha percentuali più elevate di globuli di grasso di dimensioni più piccole rispetto al latte di bovino (Tabella 5). Le differenze di dimensione dei globuli di grasso del latte proveniente da specie diverse possono influenzare la digestione dei grassi (18, 19). Il nucleo di TAG dei globuli di grasso di tutte le specie è circondato, protetto e stabilizzato da un triplo strato fosfolipidico (insieme a specifiche proteine di membrana) chiamato membrana del globulo di grasso del latte (MFGM) (68, 69). La MFGM è unica per il latte e la sua struttura è considerata simile in tutte le tipologie di latte, sebbene le percentuali delle diverse proteine nella MFGM possano differire tra le diverse specie (70). In linea generale, si ritiene che le differenze delle caratteristiche delle micelle di caseina e dei globuli di grasso nelle diverse tipologie di latte giochino un ruolo importante nell’influenzare il loro comportamento di coagulazione e l’apporto di nutrienti durante la digestione, argomento discusso nella sezione relativa alla digestione del latte.
Potenziale ipoallergenico dei latti di origine non bovina
È risaputo come più di 20 proteine contenute nel latte bovino siano capaci di scatenare reazioni allergiche; tra queste, le frazioni della caseina (in particolare αs2-, αs1- e κ-caseina e, in una certa misura, anche la β-caseina), la lattoferrina, l’albumina sierica e la β-lattoglobulina sono considerati gli allergeni più comuni del latte bovino (71-73). Sta nascendo un interesse sempre maggiore per quanto riguarda l’idoneità del latte non bovino come opzione ipoallergenica al latte di vacca (74). Alcuni studi riportano che il latte di cavalla (75), il latte d’asina (76, 77), il latte di cammella (78, 79) ed il latte di bufala (80) potrebbero essere delle potenziali alternative nei casi di moderata allergia al latte bovino nei bambini; tuttavia, questo deve essere ulteriormente studiato poiché è stata segnalata una debole reattività crociata delle proteine del latte non bovino con le proteine del latte bovino (81-83). Jenkins et al. (71) hanno condotto uno studio completo sulla reattività crociata delle proteine del latte umano e non umano, ed hanno scoperto che il grado di allergenicità di una proteina del latte non umano è correlato al grado di somiglianza con i suoi omologhi umani. Hanno scoperto che, rispetto alle proteine contenute nel latte di bovini, caprini e ovini, le proteine del latte di cammello e di cavallo (cioè αs1- e β-caseine) sono più omologhe alle loro controparti presenti nel latte umano, il che potrebbe essere una ragione della loro debole reattività crociata e della loro natura meno allergenica rispetto agli altri latti non bovini. Infante et al. (84) hanno riportato che il 25% dei pazienti sottoposti a test immunologico ha avuto risposte negative per reazioni avverse alle proteine del latte di capra; pertanto, il latte di capra non può essere considerato un’alternativa adeguata in caso di allergia al latte bovino. Analogamente, esistono prove evidenti di allergenicità o di reattività crociata positiva del latte di capra, pecora, cervo e bufala con il latte di vacca (83, 85-87). Inoltre, sono disponibili anche dei report riguardanti l’allergia selettiva alle proteine del latte di capra e di pecora, ma non alle proteine del latte bovino (88, 89). Bevilacqua et al. (90) hanno riscontrato che, nelle cavie, il latte di capra con basse percentuali di αs1-caseina (e con quantità maggiori di αs2-caseina) era significativamente meno allergenico rispetto al latte di capra con un contenuto elevato di αs1-caseina (e con basso contenuto di αs2-caseina); quindi, anche le diverse percentuali delle proteine del latte possono svolgere un ruolo chiave nel controllo dell’allergia alle proteine del latte. Nel complesso, le prove scientifiche indicano che esistono pochi presupposti per promuovere il latte non bovino (o le proteine del latte) come alternativa al latte vaccino per le persone che soffrono di allergia a questa tipologia di latte.
TABELLA 5. Dimensione dei globuli di grasso nel latte proveniente da specie diverse di mammiferi#.
#) Fonte: Adattato e modificato da Claeys et al. (19) e da Crowley et al. (13).
I valori ottenuti da altri riferimenti sono rappresentati dalle lettere maiuscole: A, Roy et al. (29).
Digestione del latte
Ruolo indispensabile della fase gastrica nella digestione del latte
Si sa che il latte sia una fonte di proteine equilibrate dal punto di vista nutrizionale ed altamente digeribili (91, 92). Studi condotti in precedenza hanno riportato che i tassi di svuotamento gastrico delle due principali frazioni proteiche del latte (cioè la caseina e le proteine del siero di latte) differivano notevolmente; questo ha portato alla formulazione del concetto che le caseine vengono digerite “lentamente” mentre le proteine del siero di latte vengono digerite “velocemente” (93-98). La digestione del latte da parte degli enzimi dello stomaco (principalmente pepsina e, in una certa misura, lipasi gastriche) in presenza di acido cloridrico è considerata il primo passaggio chiave, a cui segue un’ulteriore processo di digestione nell’intestino tenue da parte di proteasi e lipasi intestinali (99, 100). Alcuni neonati umani possono avere un enzima simile alla chimosina oltre alla pepsina, che scompare dal fluido gastrico entro l’undicesimo giorno dopo la nascita (101). La chimosina e la pepsina appartengono allo stesso gruppo di proteasi aspartiche che utilizza residui di acido aspartico nel loro sito attivo (102). Entrambi gli enzimi possono idrolizzare in via preferenziale il legame Phe105-Met106 della κ-caseina, ma la pepsina possiede anche un’attività proteolitica aspecifica verso i legami con residui di Trp, Tyr, Leu o Val, e quindi ha un’attività proteolitica maggiore per quanto concerne la sua attività di coagulazione del latte rispetto alla chimosina (102-104). Poiché il sito di azione della chimosina e della pepsina è lo stesso, il meccanismo d’azione dei due enzimi dovrebbe essere simile quando si parla di coagulazione del latte. La chimosina è più stabile nell’intervallo di pH 5.3-6.3, e perde rapidamente la sua attività in condizioni acide, cioè al di sotto di un pH di 3-4, così come a valori di pH alcalini elevati, cioè al di sopra di un pH di 9.8 (105). La pepsina ha la massima attività proteolitica a pH 2, con un intervallo di pH ottimale tra 2 e 5, e svolge la sua attività nell’intervallo di pH compreso tra 5.5 e 7.5. La pepsina viene inattivata irreversibilmente a pH superiori a 7.5 (106). I siti di idrolisi proteica della pepsina sono diversi da quelli delle proteasi intestinali (principalmente tripsina e chimotripsina). La pepsina agisce preferenzialmente sulla κ-caseina delle micelle di caseina, portando alla coagulazione della frazione della caseina delle proteine del latte in condizioni acide, mentre la frazione proteica del siero di latte rimane solubile (107). Pertanto, il ruolo iniziale svolto dallo stomaco nella digestione del latte è essenziale per la regolazione della velocità di digestione delle proteine del latte nel tratto gastroenterico (108). A questo proposito, è molto importante conoscere le metodiche digestive e le dinamiche della coagulazione del latte durante la digestione gastrica, poiché la coagulazione del latte può influire sulla velocità di rilascio di proteine, grassi e di altre componenti ad essi associate.
Prove di coagulazione del latte
È noto che il latte umano forma una cagliata molto morbida e friabile nello stomaco del neonato. Mason (109) ha studiato i cambiamenti di pH e l’entità dell’idrolisi delle proteine nel contenuto dello stomaco raccolto (utilizzando una sonda gastrica) a diversi intervalli di tempo da 25 neonati sani (nati a termine, di età compresa tra i 5 e i 13 giorni). Ha evidenziato la presenza di un coagulo formato da caseina nel contenuto dello stomaco raccolto dopo 30 minuti dall’allattamento. Ha anche riferito che era presente un’idrolisi proteica trascurabile in questi campioni. Allo stesso modo, recentemente de Oliveira et al. (110) hanno studiato la digestione gastrica del latte umano crudo e pastorizzato in neonati prematuri alimentati mediante sondino. Nel loro studio, l’analisi microstrutturale ha mostrato che il latte umano formava aggregati proteici molto morbidi e friabili nello stomaco del bambino. I lattonzoli e i suinetti in accrescimento vengono considerati un modello animale idoneo per la ricerca sulla digestione umana (111–113). I lattonzoli allattati con biberon vengono impiegati per studiare la digestione del latte umano e degli alimenti formulati per i lattanti (114–116). In letteratura sono state riportate alcune prove della formazione di coaguli (o cagliata) di latte bovino nei lattonzoli o nei suinetti. Washburn e Jones (117) hanno evidenziato che il latte scremato bovino formava un coagulo compatto o molto consistente, mentre il latte intero bovino formava una cagliata più friabile e pastosa nello stomaco dei maialini (28-35 giorni di età) e che, maggiore era il contenuto di grasso più morbida era la cagliata che si formava. Braude et al. (118) hanno scoperto che le caseine del latte bovino omogeneizzato si coagulavano nello stomaco del suinetto di 28 giorni d’età dopo 15-30 minuti di alimentazione, mentre la frazione “sierica” del latte rimaneva solubile e passava rapidamente nell’intestino tenue. Allo stesso modo, Decuypere et al. (119) hanno evidenziato la formazione di coaguli di caseina compatti nello stomaco di suinetti svezzati precocemente (10-29 giorni di età) ed alimentati con prodotti in polvere a base di latte bovino; il loro chimo gastrico aveva un lungo tempo di ritenzione e una bassa capacità tampone e stimolava un maggiore rilascio di gastrina, rispetto al contenuto gastrico dei lattonzoli alimentati con latte di scrofa. Ritenevano che queste differenze fossero dovute alla compattezza del coagulo di caseina formatosi in seguito ad un’alimentazione a base di latte bovino in polvere nei suini svezzati precocemente rispetto al morbido coagulo di caseina formatosi dopo l’ingestione di latte di scrofa nei suinetti allattati.
Caratteristiche del coagulo e gli effetti del latte umano e bovino
È risaputo che il latte bovino forma una cagliata compatta (o coaguli) nello stomaco, rispetto al latte umano. Nakai e Li-Chan (108) hanno studiato le caratteristiche di coagulazione del latte umano e bovino utilizzando un test di precipitazione acida in vitro a 37° C, durante il quale hanno aggiunto una soluzione di pepsina acida allo 0.2% a 100 ml di latte bovino e di latte umano, con una velocità del flusso di 15 ml/h. Hanno scoperto che il latte umano formava degli aggregati (o coaguli) proteici molto più fini del latte bovino, ed hanno riferito che questa potrebbe essere la possibile spiegazione del perché il tempo di svuotamento gastrico per il latte umano è più breve. Le differenze tra cagliata di latte umano e cagliata di latte bovino evidenziabili nella struttura del coagulo potrebbero essere correlate alle differenze nelle composizioni di grassi e proteine. Il rapporto proteine (caseina)/grassi del latte umano è molto basso (tabelle 1, 2) rispetto a quello del latte bovino (così come quello di altre tipologie di latte non bovino), fattore che probabilmente è responsabile della formazione di una cagliata morbida (o friabile). Inoltre, nel latte umano il maggior rapporto β-caseina/αs-caseina viene associato alla formazione di una cagliata fine e meno compatta nello stomaco del neonato. Lichan e Nakai (120) hanno condotto uno studio di coagulazione in vitro utilizzando caseina di latte bovino non trattata, caseina di latte bovino modificata con rennina e caseina di latte umano. La caseina del latte bovino modificata con rennina dava origine ad un latte bovino ricco di β-caseina (simile al latte umano ricco di β-caseina) che veniva prodotto eliminando selettivamente la frazione αs1 della caseina mediante un processo che prevedeva l’utilizzo del caglio. Dopo l’acidificazione delle diverse soluzioni di caseina a pH 2 o pH 4, Lichan e Nakai (120) hanno osservato che la durezza del coagulo formatosi da queste diverse soluzioni di caseina diminuiva secondo questo ordine: caseina del latte bovino > caseina del latte bovino modificata con rennina (ricca in β-caseina) > caseina umana. In un altro studio, Lichan e Nakai (121) hanno messo in evidenza anche che la defosforilazione moderata o parziale della caseina del latte bovino tramite fosfatasi diverse (fosfatasi alcalina intestinale di vitello e fosfatasi acida della patata) a pH 4, faceva sì che le proprietà acido-coagulanti di queste soluzioni di caseina del latte bovino modificate fossero simili a quelle del latte umano e con un tasso di proteolisi maggiore rispetto ai coaguli compatti di caseina del latte bovino non trattato. Tuttavia, tutti questi studi erano studi fisico-chimici in vitro quindi dovrebbero essere effettuati ulteriori studi con modelli di digestione in vitro o in vivo per poter convalidare tali risultati. Blakeborough et al. (122) hanno studiato la digestione del latte umano, del latte bovino e del latte artificiale ricostituito (a base di latte intero di bovino in polvere) utilizzando suinetti di 14 giorni d’età; il latte di bovino o il latte artificiale formavano una cagliata solida e compatta, mentre il latte umano formava un coagulo abbastanza liquido (con poco materiale solido) nel tratto gastroenterico superiore del suinetto. Hanno anche determinato la biodisponibilità dello zinco (Zn) impiegando sempre queste tipologie di latte; hanno scoperto che, per quanto riguardava il latte bovino (così come il latte artificiale), il 55-72% circa e il 60-66% circa dello Zn veniva trattenuto, rispettivamente, nella cagliata presente nel chimo gastrico e nel contenuto intestinale, mentre per il latte umano, il 43% circa e il 7% dello Zn veniva trattenuto, rispettivamente, nella cagliata presente nel chimo gastrico e nel contenuto intestinale. Hanno suggerito che tali differenze nella distribuzione e nella biodisponibilità dello Zn nel tratto gastrointestinale dei suinetti alimentati con latte umano o bovino potrebbero essere dovute alle differenze riscontrate nella consistenza della cagliata della caseina che si forma dai diversi latti.
Digestione del latte proveniente da specie diverse
Digestione della proteina
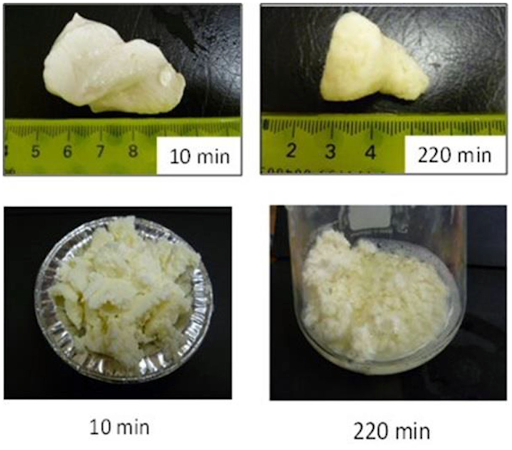
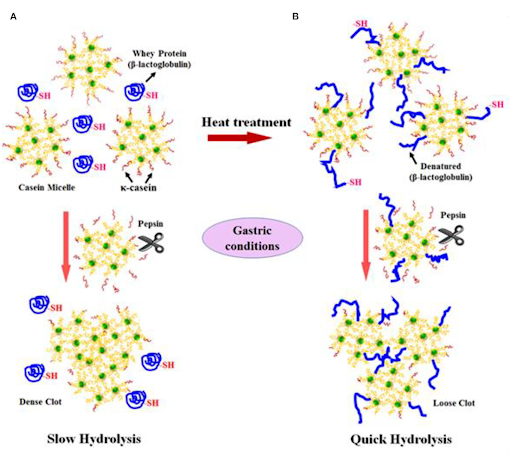
Il minor contenuto proteico, il rapporto caseina/proteine del siero di latte più basso ed il rapporto β-caseina/αs-caseina più elevato del latte umano rispetto al latte di altre specie sono stati correlati alle sue capacità di formare una cagliata morbida in vitro ed in vivo, come descritto in precedenza. Sebbene nessuno dei latti degli altri mammiferi abbia una composizione simile a quella del latte umano, è noto che il latte di cavalla e d’asina formano un gel (o cagliata o fiocchi) poco consistente o friabile quando acidificato o trattato con caglio (123-125), quindi ci si aspetta che formino una cagliata morbida o friabile nello stomaco, rispetto a quella che si otterebbe da latte bovino, visto anche il loro contenuto di caseina inferiore. Allo stesso modo, si ritiene che alcune tipologie di latte di ruminanti, come quello di capra e di cammello (126-130), formino una cagliata molle nello stomaco quando acidificati o trattati con caglio (o pepsina), a causa del loro minor contenuto di caseina o a causa di micelle di caseina di dimensioni più grandi rispetto a quelle del latte bovino, sebbene contengano percentuali di caseine relativamente maggiori rispetto al latte equino ed umano. Tuttavia, finora non sono stati condotti studi comparativi diretti sulla digestione in vitro o in vivo tra latte di bovini e di non bovini, incentrati sulle caratteristiche di formazione della loro cagliata nello stomaco. Esistono solo pochi studi comparativi sulla digestione in vitro che riguardano il latte bovino e quello non bovino, e sono incentrati sulla digestione delle proteine o dei grassi. Jasińska (131) ha messo a confronto i gradi di idrolisi (con pepsina e tripsina) delle micelle di caseine ottenute da latte scremato di bovini, umani, caprini e equini; i tassi di idrolisi peptica delle micelle di caseina contenute nel latte di bovini, umani, caprini ed equini erano, rispettivamente, del 23-42% (differivano a seconda delle diverse razze di bovini), dell’80%, del 65% e del 43%. I tassi di idrolisi tramite tripsina delle caseine micellari provenienti da latte di bovini, umani, caprini ed equini erano, rispettivamente, del 76-90%, del 100%, del 96% e del 92%. Gli autori hanno ipotizzato che la maggiore suscettibilità del latte umano e di capra fosse dovuta alla presenza di aggregati micellari più piccoli e alla presenza di percentuali più elevate di β-caseina nelle loro strutture micellari, rispetto al latte bovino (che invece aveva percentuali maggiori di αs1-caseina). Recentemente, Hodgkinson et al. (132) hanno studiato la digestione gastrica statica in vitro del latte intero di bovino e di capra (a pH 3.0) ed hanno riferito che dopo 20-60 minuti di digestione, le caseine del latte di capra venivano digerite più velocemente delle caseine del latte bovino (in base alla analisi elettroforetica su gel SDS-PAGE), probabilmente a causa del coagulo relativamente più morbido o friabile formato dal latte di capra. Tagliazucchi et al. (133) hanno studiato la digestione gastroenterica statica in vitro del latte scremato di bovino, capra, pecora e cammello (secondo il protocollo INFOGEST) ed hanno riportato che la quantità di gruppi amminici liberi generati durante la digestione gastrica era maggiore per le proteine del latte di capra, pecora e cammello, evidenziando come le proteine contenute in questi latti non bovini venissero idrolizzate più velocemente delle proteine del latte bovino durante la fase gastrica. Tuttavia, dopo la fase intestinale, hanno riscontrato che solamente le proteine del latte di capra venivano idrolizzate più velocemente rispetto alle proteine del latte delle altre specie, che avevano tutte tassi di idrolisi simili. Tagliazucchi et al. (134) e Rutella et al. (135) hanno segnalato risultati simili in loro studi precedenti, vale a dire che il grado di idrolisi delle proteine del latte scremato di capra durante le fasi gastrica ed intestinale era molto più elevato di quello delle proteine del latte scremato di bovino. Gli autori hanno affermato che il maggiore grado di idrolisi delle proteine del latte di capra osservato in tutti gli studi era probabilmente dovuto alla maggiore suscettibilità alla pepsina delle proteine contenute in questo latte. Maathuis et al. (136) hanno studiato la digeribilità e le relative qualità (basate su azoto e amminoacidi biodisponibili) delle proteine del latte umano, del latte artificiale per neonati a base di latte bovino e del latte artificiale per neonati a base di latte di capra utilizzando il modello Tiny-TIM (un modello gastroenterico dinamico di neonato in vitro). Hanno scoperto che la digeribilità delle proteine e le qualità di tutte le diete erano simili; tuttavia, la velocità di digestione delle proteine era più lenta durante i primi 60 minuti di digestione del latte artificiale per neonati a base di latte di bovino rispetto a quella del latte umano e del latte artificiale a base di latte di capra. Hanno ipotizzato che le differenze nelle caratteristiche di coagulazione delle diverse tipologie di latte avrebbero portato a differenze nello svuotamento gastrico, poiché hanno visto che la cagliata formatasi dal latte artificiale a base di latte bovino rimaneva per un periodo più lungo nel compartimento gastrico del Tiny-TIM rispetto a quella che si formava dal latte materno e dal latte artificiale per neonati a base di latte di capra. Allo stesso modo, Ye et al. (32) hanno studiato la digestione gastrica dinamica in vitro di formulazioni per neonati a base di latte di capra e bovino in una mini versione del simulatore gastrico umano (HGS), simulando la digestione gastrica infantile. Gli autori hanno scoperto che il latte artificiale per neonati a base di latte di capra formava aggregati proteici più piccoli nel mini-HGS (favorendo una idrolisi più rapida delle sue proteine) rispetto a quelli derivanti dalla formulazione artificiale a base di latte bovino. Sulla base degli studi sopra citati sembra che le differenze strutturali della cagliata che si forma dal latte delle diverse specie durante la digestione gastrica possano essere un fattore chiave responsabile delle diverse modalità di digestione. Al contrario, Almaas et al. (137) non hanno riscontrato alcuna differenza nella digestione delle caseine e della α-lattoalbumina contenute nel latte scremato di bovini e capre (con contenuto di αs1-caseina alto e basso ) dopo digestione gastroenterica statica utilizzando succo gastrico umano (HGJ) e succo duodenale umano (HDJ). Inoltre, non hanno riscontrato differenze tra il latte di capra con contenuto elevato e con contenuto basso di caseina dopo digestione con HGJ e HDJ. Tuttavia, hanno osservato (utilizzando l’analisi SDS-PAGE) che la β-lattoglobulina del latte di capra veniva digerita rapidamente sia durante la digestione gastrica che durante la digestione intestinale, rispetto alla β-lattoglobulina del latte di bovino. El Zahar et al. (138) hanno studiato l’idrolisi della β-lattoglobulina proveniente dal latte di pecora e di vacca da parte della pepsina suina, ed hanno scoperto che la β-lattoglobulina contenuta nel latte di pecora veniva idrolizzata più velocemente a causa della sua struttura terziaria leggermente diversa e della sua maggiore idrofobicità superficiale. Poiché la β-lattoglobulina è considerata uno dei principali allergeni (è assente nel latte umano), la marcata idrolisi da parte della pepsina della β-lattoglobulina nel latte di capra e di pecora può essere una possibile ragione per cui questi latti vengono meglio tollerati da alcune persone rispetto al latte bovino. Vithana et al. (23) hanno studiato la digestione gastrointestinale comparativa in vitro del latte bovino crudo e del latte scremato di cervo. Hanno scoperto che, dopo la digestione gastrica, quasi il 49% e il 27% delle caseine del latte di cervo e di quello bovino rimanevano indigerite (analisi SDS-PAGE), mentre dopo digestione intestinale, le caseine di entrambe le specie risultavano completamente digerite. Ciò indicava che, durante la digestione gastrointestinale, le caseine del latte di cervo venivano digerite più velocemente rispetto alle caseine del latte bovino. Secondo la nostra ipotesi, i maggiori quantitativi di caseine nel latte scremato di cervo rimasti durante la fase gastrica possono essere dovuti ad un più alto contenuto proteico (al di là del contenuto di caseina) del latte di cervo utilizzato nel loro studio, e ciò sottolinea come anche la composizione intrinseca del latte abbia un ruolo chiave durante la sua digestione gastrica. Vithana et al. (23) hanno anche scoperto che l’α-lattoalbumina veniva idrolizzata più velocemente nel latte di cervo che nel latte di bovino. Invece la β-lattoglobulina di entrambe le specie risultava essere resistente sia alla digestione gastrica che a quella duodenale. Contrariamente agli studi sopra descritti, altri studi non riportavano nessuna differenza o un’idrolisi più rapida delle proteine del latte bovino rispetto alle proteine del latte di capra. Ad esempio, Inglingstad et al. (139) hanno riportato (sulla base dell’analisi SDS-PAGE) che il 69% e l’82% delle caseine risultavano indigerite dopo idrolisi con HGJ del latte scremato di bovino e di capra, rispettivamente; tuttavia, dopo un ulteriore trattamento con HDJ, quasi tutte le caseine del latte di entrambe le specie sono state digerite. Hanno scoperto che la β-lattoglobulina e la α-lattoalbumina di entrambe le specie erano altamente resistenti all’HGJ e che, dopo idrolisi con HDJ, il 64% circa della β-lattoglobulina del latte di entrambe le specie rimaneva indigerita e che il 91% e il 65% della α-lattoalbumina proveniente, rispettivamente, dal latte scremato di bovino e di capra non veniva digerita. Mros et al. (140) non hanno evidenziato differenze nella digestione delle proteine del latte scremato di bovini, capre e pecore dopo idrolisi mediante pepsina e pancreatina. Allo stesso modo, Milan et al. (141) hanno riferito che il latte intero di capra fortificato con proteine, rispetto al latte intero vaccino sempre fortificato con proteine, veniva digerito e metabolizzato in maniera analoga (nonostante le differenze nella loro composizione nutrizionale intrinseca) nei giovani adulti (di età compresa tra i18 e i 28 anni). Inoltre, hanno disciolto del paracetamolo nel latte fortificato da bere prima di darlo ai partecipanti affinché lo consumassero (i livelli plasmatici di paracetamolo sono stati utilizzati come marker per lo svuotamento gastrico). Va notato che, a seconda della tipologia di paracetamolo utilizzata, si può avere un effetto tampone durante la digestione gastrica nello stomaco (142) e quindi è necessario fare delle attente considerazioni durante gli studi sulla digestione umana per trarre conclusioni definitive. Vaisman et al. (143) hanno studiato i tempi di svuotamento gastrico negli esseri umani del latte di cammello e di quello bovino utilizzando una tecnica scintigrafica, ed hanno riscontrato che le scarse proprietà coagulative del latte di cammello (osservate durante la coagulazione con acido o con caglio) non fornivano alcun vantaggio competitivo rispetto al latte di bovino in termini di svuotamento gastrico. Va detto che la cagliata morbida o friabile formatasi da latte non bovino (come latte di cammello, capra, cavallo e asina) durante la coagulazione acida o con caglio fornisce solamente un’indicazione di come questi latti alternativi possano comportarsi all’interno dello stomaco umano durante la digestione gastrica. Il processo di digestione gastrica è complesso e dinamico e per trarre conclusioni definitive è necessario intraprendere studi comparativi approfonditi in vitro ed in vivo (su latte bovino e non) che siano in grado di simulare la digestione gastrica negli esseri umani. Non solo la composizione proteica e (o) la struttura delle micelle di caseina sono importanti, ma anche le diverse combinazioni di temperatura e dei tempi di lavorazione possono generare differenze nella struttura della cagliata nello stomaco, che a loro volta possono influenzare la velocità di rilascio delle proteine nell’intestino tenue e il loro successivo assorbimento. Ad esempio, Ye et al. (107) hanno studiato la digestione gastrica dinamica del latte scremato bovino crudo e riscaldato (90° C per 20 minuti) utilizzando un HGS. L’HGS è un modello dinamico di stomaco in grado di simulare le forze di contrazione dello stomaco e il flusso dei succhi gastrici che si verificano in vivo (144). Ye et al. (107) hanno scoperto che il latte crudo formava un coagulo compatto “a maglia stretta”, mentre il latte riscaldato formava aggregati proteici sottili e lassi (Figura 2), e tale coagulo più compatto portava ad una più lenta idrolisi delle caseine del latte crudo. Questo perché, nel latte crudo, solo le caseine erano coinvolte nella formazione del coagulo, mentre nel latte riscaldato sia le caseine che le proteine del siero di latte denaturate venivano coinvolte nella formazione del coagulo (145). Il riscaldamento a 90° C per 20 minuti avrebbe portato alla formazione di complessi tra le proteine del siero di latte completamente denaturate e le caseine tramite gruppi sulfidrilici e legami disolfuro (Figura 3), ostacolando così la formazione di un coagulo più compatto (146, 147). Kaufmann (148) ha riferito che il latte trattato con temperature molto elevate (UHT) formava coagulati molli nello stomaco dei suinetti, portando alla comparsa di livelli più alti di aminoacidi ed urea nel siero ematico rispetto al latte pastorizzato e crudo, che invece formavano un coagulo più compatto. Pertanto, si ipotizza che queste differenze strutturali che si creano a livello gastrico ed indotte dal riscaldamento del latte possano essere un aspetto chiave per un maggiore utilizzo postprandiale da parte dell’uomo dell’azoto contenuto nel latte magro UHT (140° C per 5 secondi) piuttosto che nel latte magro pastorizzato (72° C per 20 secondi) o nel latte magro microfiltrato (149). All’inizio del 1900 Doan (150) ha pubblicato una review completa che si basava su studi sulla digestione gastrica del latte bovino trasformato (bollito, evaporato o acidificato) e crudo, ed ha evidenziato che il latte bollito, evaporato o acidificato veniva eliminato rapidamente dallo stomaco umano a causa della cagliata più sottile o più morbida che si formava. È stato suggerito che modificare il latte bovino crudo (utilizzando i diversi processi di lavorazione) potrebbe essere una potenziale opzione per lo sviluppo di alimenti per bambini o bevande a base di latte con proprietà simili a quelle del latte umano. Ad oggi, non sono stati riportati in letteratura studi sull’impatto delle diverse tipologie di riscaldamento (o di lavorazione del latte) sulla digestione dei latti non bovini. Va detto che la trasformazione per la messa in commercio o le tecnologiche impiegate per la lavorazione del latte non bovino potrebbero differire da quelle necessarie per la lavorazione del latte bovino. Inoltre, l’impatto delle diverse metodiche di lavorazione sulla digestione del latte non bovino potrebbe essere diverso da quello sul latte bovino, a causa delle differenze nella loro composizione e struttura.
FIGURA 2. Immagini dei coaguli formati durante la digestione gastrica di 200 g di latte bovino scremato non riscaldato (riga superiore) e riscaldato (riga inferiore) in diversi momenti della digestione. Fonte: Adattato da Ye et al. (107).
FIGURA 3. Diagramma schematizzato del possibile meccanismo di eventi durante la formazione della cagliata proteica a partire da (A) latte crudo (non riscaldato) e (B) latte riscaldato durante il processo di digestione. Fonte: Adattato da Ye et al. (145).
Influenza dell’insieme proteico sulla digestione dei grassi – la matrice del latte intero
Durante la digestione gastrica del latte intero, è noto che i globuli di grasso vengono fisicamente intrappolati all’interno del coagulo proteico che si forma. Pertanto, la natura o la struttura della rete proteica che si forma influenzerà la velocità di rilascio e la digestione dei grassi da parte delle lipasi gastrointestinali (145, 151–153). Studi condotti in precedenza hanno dimostrato che la natura (o la struttura) della rete proteica che si forma dipende, a sua volta, dalla composizione proteica (rapporto caseina-proteine del siero), dal rapporto proteine-grassi e dall’impatto delle diverse condizioni di lavorazione (99 , 154). Ad esempio, Mulet-Cabero et al. (154) hanno studiato, utilizzando un modello gastrico semi dinamico, la digestione gastrointestinale in vitro di sistemi modello basati su diversi rapporti caseina-proteine del siero, ed hanno riferito che la viscosità (o la compattezza) del coagulo formato aumentavano all’aumentare del rapporto caseina-proteine del siero nei sistemi modello, portando ad uno svuotamento gastrico più lento e ad una digestione ed assorbimento dei nutrienti più lenti. Hanno anche scoperto che l’aggiunta di quantità crescenti di grassi ai modelli proteici ricchi di caseina produceva coaguli più frammentati e con una significativa diminuzione della loro compattezza. Ciò ci indica che la presenza di grasso ostacolava l’aggregazione proteica, che a sua volta, può influire sui tassi di digestione dei nutrienti. Ye et al. (151) hanno studiato la digestione gastrica del latte intero bovino crudo (non riscaldato) e riscaldato (a 90° C per 20 minuti) ed hanno visto che il rilascio dei globuli di grasso dipendeva dalle caratteristiche di rottura del coagulo proteico e che era maggiore dagli aggregati di coaguli proteici meno compatti che si formavano a partire dal latte intero riscaldato piuttosto che dai coaguli più consistenti che si formavano dal latte intero crudo (Figura 4). Inoltre, Ye et al. (145) hanno studiato le digestioni gastriche in vitro e in vivo (nei ratti) del latte intero bovino crudo (non omogeneizzato), pastorizzato (omogeneizzato) e UHT (omogeneizzato) ed hanno riferito che il latte UHT aveva elevati tassi di idrolisi proteica, nonché un maggior rilascio di globuli di grasso, durante la digestione gastrica, rispetto al latte crudo e a quello pastorizzato; le differenze sono state attribuite alla presenza di aggregati proteici più piccoli o frammentati formati dalle proteine del latte UHT. In un altro studio sulla digestione gastrica, Ye et al. (152) hanno riscontrato che il rilascio dei globuli di grasso era relativamente più alto nel latte omogeneizzato (20/5 MPa (pressione primaria/secondaria), a 20° C) così come nel latte omogeneizzato e riscaldato (20/5 MPa, 20° C + 90° C per 20 min), vista la struttura sottile e friabile del coagulo che si formava da questi latti rispetto al coagulo solido che si formava da latte intero bovino crudo (Figura 5). Risultati simili sono stati riportati da Mulet-Cabero et al. (153) per il latte intero bovino trasformato. La coalescenza dei globuli di grasso intrappolati nella maglia proteica, così come di quelli presenti nella fase liquida del chimo gastrico, è stata riportata anche negli studi sopra menzionati (145, 152, 153), e dovrebbe essere dovuta all’idrolisi delle proteine presenti sulla superficie del globulo di grasso del latte (presenti naturalmente nella MFGM o proteine adsorbite a causa dei trattamenti di lavorazione), che porta alla destabilizzazione dei globuli di grasso. Dato che il latte proveniente dalle diverse specie varia in termini di contenuto di grassi, rapporto proteine/grassi, dimensione e struttura dei globuli di grasso, potrebbero esserci differenze nella consistenza del coagulo formato da latte di specie diverse durante la digestione gastrica, cosa che nel complesso può andare ad influenzare la sua digestione.
FIGURA 4. Cambiamenti nel contenuto di grassi (g/100 g di latte) nei coaguli ottenuti a partire da (•) latte bovino intero non riscaldato (crudo) e (⸰) riscaldato durante la digestione gastrica. Fonte: adattato da Ye et al. (151).
FIGURA 5. Immagini dei coaguli formatisi durante la digestione gastrica di latte bovino intero crudo (non riscaldato), omogeneizzato e riscaldato ed omogeneizzato al 20° e al 160° minuto della digestione. Fonte: adattato da Ye et al. (152).
Digestione gastroenterica dei grassi
Sono disponibili poche informazioni sulla digestione gastrica dei grassi del latte, indipendentemente dalla specie. In passato la lipolisi della fase gastrica veniva considerata di minore rilevanza durante il processo digestivo generale, dato che la lipolisi gastrica rappresenta solo il 10-25% della digestione lipidica complessiva negli adulti (155). Pertanto, la maggior parte degli studi riportati in letteratura sulla digestione dei grassi si concentravano principalmente sulla digestione che avviene a livello intestinale. Tuttavia, oggi si consiglia di incorporate negli studi di digestione in vitro anche le lipasi gastriche, poiché il loro ruolo preliminare può facilitare l’ulteriore scomposizione dei lipidi da parte delle lipasi intestinali (155). Inoltre, a differenza degli adulti, nei neonati le lipasi gastriche svolgono un ruolo significativo a causa del loro elevato pH gastrico postprandiale (156). Si suppone che, minore è la dimensione dei globuli di grasso del latte, maggiore sarà la sua digeribilità, poiché la superficie più estesa dei piccoli globuli di grasso aiuterà nella digestione rapida promossa dalle lipasi gastrointestinali (13, 18, 19, 157). Meena et al. (158) hanno studiato la digestione del grasso del latte ad opera della lipasi pancreatica nel latte intero standardizzato di bovini, bufali, cammelli e capre. Gli autori hanno scoperto che la quantità di acidi grassi liberi rilasciati seguiva l’ordine: capra ∼ cammella > bovino > bufalo. Si è ipotizzato che la maggior digeribilità del latte intero di capra e di cammella fosse dovuta alle piccole dimensioni dei loro globuli di grasso, dato che le dimensioni dei globuli di grasso nei diversi latti erano, nell’ordine: bufala (3.9–7.7 μm) > bovini (1.6–4.9 μm) > capra (1.1–3.9 μm) ∼ cammello (1.1–2.1 μm). Oltre alle dimensioni, anche la superficie esterna del globulo di grasso e la sua struttura (cioè l’interfaccia del globulo di grasso) svolgono un ruolo cruciale nella digestione dei grassi. Ad esempio, la presenza di proteine adsorbite (legata a processi come il riscaldamento e l’omogeneizzazione del latte) sull’interfaccia dei globuli di grasso può facilitare l’accesso delle lipasi al core costituito da TAG e quindi influire sulla digestione del grasso del latte (157). Alcuni studi hanno dimostrato anche quanto influiscano le differenze di composizione dei grassi del latte (a seconda delle diverse tipologie di latte esaminato) sulla loro digeribilità. Ad esempio, Alférez et al. (159) hanno studiato la digeribilità ed il metabolismo dei grassi in campioni di feci di ratti albini maschi alimentati con diete contenenti latte intero liofilizzato di capra e bovino. Hanno scoperto che, rispetto ai ratti alimentati con dieta a base di latte di bovino, in quelli alimentati con dieta a base di latte di capra la digestione dei grassi era maggiore e i livelli di colesterolo erano più bassi. Gli autori ritengono che le differenze possano essere dovute alle maggiori quantità di TAG a catena media e alle dimensioni più piccole dei globuli di grasso presenti nel latte di capra rispetto alle dimensioni dei globuli di grasso del latte di bovino utilizzato nel loro studio. Analogamente, Teng et al. (160) hanno studiato la digestione gastrica in vitro del latte bovino e di pecora sia crudo (non omogeneizzato) che omogeneizzato, ed hanno evidenziato che i TAG del latte di pecora (sia crudo che omogeneizzato) venivano digeriti più rapidamente dalle lipasi gastriche di coniglio rispetto a quelli del latte di bovino; questo era dovuto alla presenza, nel latte di pecora, di livelli più alti di acidi grassi a catena media in posizione sn-1 o sn-3 della struttura del TAG, e ciò sottolinea l’importanza delle caratteristiche strutturali dei TAG durante la digestione gastrica. Nel complesso, è probabile che la digeribilità delle proteine e dei grassi del latte sia in funzione della loro composizione unica, dei profili proteici, della composizione dei grassi, delle micelle di caseina e delle strutture dei globuli di grasso, delle proprietà dell’interfaccia, della distribuzione dei minerali e delle proprietà fisico-chimiche, tutte caratteristiche che possono essere influenzate in misura diversa dai processi di lavorazione e dalla specie animale esaminata. Sebbene in letteratura vi siano pochissimi studi sull’impatto dei processi di lavorazione e sulla composizione dei latti non bovini, si è ipotizzato che i principi della coagulazione delle proteine del latte bovino, ed il suo impatto sulla digestione dei grassi, fossero applicabili anche ai latti non bovini. Tuttavia, poiché i latti bovini e quelli non bovini variano nella composizione proteica (percentuale delle diverse proteine) e nel rapporto proteine/grassi, è probabile che ci siano differenze per quanto riguarda la struttura e la consistenza della cagliata (o del coagulo) proteica che si forma da queste diverse tipologie di latte, che possono portare ad ulteriori differenze nel rilascio dei globuli di grasso dalla matrice del coagulo. Va anche detto che le modalità di digestione gastrica e intestinale dei neonati (così come degli anziani) sono diverse da quelle degli adulti in termini di secrezioni acide e di attività degli enzimi (proteasi e lipasi) (155, 156, 161). Pertanto, è necessario utilizzare idonei modelli dinamici in vitro per studiare la digestione del latte nei diversi gruppi di età e i risultati devono essere infine confermati sulla base di osservazioni in vivo.
Conclusioni e suggerimenti per la ricerca futura
Poiché il latte ed i prodotti lattiero-caseari non di origine bovina vengono spesso considerati come una potenziale fonte di nutrimento per l’uomo, potrebbero essere impiegati per realizzare prodotti specifici per persone di tutte le fasce età. I latti diversi da quello bovino, destano grande interesse sia nelle persone che nel settore industriale, a causa delle loro migliori proprietà nutritive percepite rispetto al latte bovino. Tuttavia, la maggior parte di queste supposizioni si basa su aneddoti, ed esiste solamente poca ricerca scientifica utile comprendere le proprietà nutrizionali e fisico-chimiche dei latti diversi da quello bovino. Una nozione ampiamente recepita riguarda la formazione di una cagliata dalla consistenza molle nello stomaco umano in seguito al consumo di alcune tipologie di latte non bovino (come il latte di capra, cammello, cavallo e asina). Per questo motivo, questi latti vengono considerati come meglio digeribili e tollerabili da persone di diverse fasce d’età. Tuttavia, ad oggi, non sono stati riportati studi scientifici diretti e vi è una mancanza di conoscenze. Poiché i latti bovini e non bovini hanno una composizione ed una struttura delle micelle di caseina e dei globuli di grasso variabile, è probabile che si comportino in modo diverso nel tratto gastrointestinale, andando ad influire probabilmente sulla cinetica della digestione e sulla biodisponibilità dei nutrienti. A causa delle differenze nella composizione del latte e nella struttura delle micelle di caseina (o dei globuli di grasso), potrebbero esserci differenze nella formazione della cagliata nello stomaco, che potrebbero ulteriormente influenzare i tassi di rilascio dei macronutrienti nelle porzioni più distali del tratto gastrointestinale. Inoltre diversi processi di lavorazione del latte, come la pastorizzazione o l’UHT (o altri trattamenti termici), possono influenzare in maniera diversa le modalità di digestione dei latti non bovini. Pertanto, è necessario condurre studi scientifici approfonditi per comprendere l’impatto delle differenze di composizione e di struttura del latte delle diverse specie (sia in forma naturale che trasformato) sulle modalità di digestione dinamica, concentrandosi in particolare sulle differenze che esistono tra questi latti per quanto riguarda la formazione della cagliata e le loro proprietà di disgregazione nello stomaco. Tali studi dovrebbero impiegare modelli di digestione in vitro, che, ove possibile, dovrebbero essere sufficientemente dinamici e sofisticati da prevedere almeno gli effetti di variabili chiave conosciute perché in grado di influire sulla digestione degli alimenti. Inoltre, l’importanza fisiologica di tali fenomeni dovrebbe essere analizzata attraverso studi condotti sugli animali e sull’uomo che si concentrino sui diversi gruppi di età o su persone che necessitano di un’alimentazione personalizzata e mirata (come neonati, anziani, atleti o persone malnutrite).
Composition, Structure, and Digestive Dynamics of Milk From Different Species-A Review
Frontiers in Nutrition | www.frontiersin.org
Debashree Roy, Aiqian Ye, Paul J. Moughan e Harjinder Singh*
Riddet Institute, Massey University, Palmerston North, Nuova Zelanda.
* h.singh@massey.ac.nz
Ricevuto: 29 Giugno 2020
Accettato: 02 Settembre 2020
Pubblicato: 06 Ottobre 2020
Edito da: David A. Sela, University of Massachusetts Amherst, Stati Uniti
Revisionato da: Nauman Khalid, University of Management and Technology, Lahore, Pakistan; Marco Iammarino, Istituto Zooprofilattico Sperimentale di Puglia e Basilicata (IZSPB), Italia
Sezione speciale: Questo articolo è stato inviato a Food Chemistry, una sezione del giornale Frontiers in Nutrition
Citazione: Roy D, Ye A, Moughan PJ and Singh H (2020) Composition, Structure, and Digestive Dynamics of Milk From Different Species—A Review. Front. Nutr. 7:577759. doi: 10.3389/fnut.2020.577759
Contributi degli autori
DR ha preparato la bozza originale e ha curato la stesura manoscritto. HS ha analizzato in maniera critica e curato la bozza originale del manoscritto. AY e PM hanno sottoposto a review critica il manoscritto. Tutti gli autori elencati hanno dato un contributo sostanziale, diretto ed intellettuale all’ideazione ed alla progettazione del manoscritto ed hanno letto e approvato il manoscritto finale per la pubblicazione.
Finanziamenti
Questo lavoro ha ricevuto finanziamenti dal Tertiary Education Commission–Center of Research Excellence (CoRE), Nuova Zelanda.
Ringraziamenti
Gli Autori vogliono ringraziare il Riddet Institute (Massey University) per la borsa di studio per il PhD di DR.
Riferimenti
1. Dunne J, Evershed RP, Salque M, Cramp L, Bruni S, Ryan K, et al. First dairying in green Saharan Africa in the fifth millennium BC. Nature. (2012) 486:390–94. doi: 10.1038/nature11186
2. Evershed RP, Payne S, Sherratt AG, Copley MS, Coolidge J, Urem- Kotsu D, et al. Earliest date for milk use in the near East and southeastern Europe linked to cattle herding. Nature. (2008) 455:528–31. doi: 10.1038/nature07180
3. Faye B, Konuspayeva G. The sustainability challenge to the dairy sector – the growing importance of non-cattle milk production worldwide. Int Dairy J. (2012) 24:50–56. doi: 10.1016/j.idairyj.2011. 12.011
4. Park YW, Haenlein GFW. Overview of milk of non-bovine mammals. In: Park YW, Haenlein GFW, editors. Handbook of Milk of Non-Bovine Mammals. Oxford: Blackwell Publishing Professional (2006). p. 3–9. doi: 10.1002/9780470999738.ch1
5. Verduci E, D’Elios S, Cerrato L, Comberiati P, Calvani M, Palazzo S, et al. Cow’s milk substitutes for children: nutritional aspects of milk fromdifferent mammalian species, special formula and plant-based beverages. Nutrients. (2019) 11:1739. doi: 10.3390/nu11081739
6. Ribeiro AC, Ribeiro SDA. Specialty products made from goat milk. Small Rumin. Res. (2010) 89:225–33. doi: 10.1016/j.smallrumres.2009. 12.048
7. Haenlein GFW. Goat milk in human nutrition. Small Rumin Res. (2004) 51:155–63. doi: 10.1016/j.smallrumres.2003.08.010
8. Alichanidis E, Moatsou G, Polychroniadou A. Composition properties of non-cow milk products. In: Tsakalidou E, Papadimitriou K, editors. Non- BovineMilkMilk Products.New York,NY: Academic Press (2016). p. 81–116. doi: 10.1016/B978-0-12-803361-6.00005-3
9. Park YW, Guo M. Goat milk products: types of products, manufacturing technology, chemical composition, and marketing. In: Park YW, Haenlein GFW, editors. Handbook ofMilk of Non-BovineMammals.Oxford: Blackwell Publishing, Ltd (2006). p. 59–106. doi: 10.1002/9780470999738.ch4
10. Burgess K. Key requirements for milk quality and safety: a processor’s perspective. In: Griffiths MW, editor. Improving the Safety and Quality of Milk Volume 1. Cambridge,UK:Woodhead Publishing Ltd (2010). p. 64–84. doi: 10.1533/9781845699420.1.64
11. Bencini R, Atzori AS, Nudda A, Battacone G, Pulina G. Improving the quality and safety of sheep milk. In: Griffiths MW, editor. Improving the Safety andQuality ofMilk–Volume 2. Cambridge,UK:Woodhead Publishing Ltd (2010). p. 347–401. doi: 10.1533/9781845699437.3.347
12. Regenstein JM, Chaudry MM, Regenstein CE. The kosher and halal food laws. Compr Rev Food Sci Food Saf. (2003) 2:111–27. doi: 10.1111/j.1541-4337.2003.tb00018.x
13. Crowley SV, Kelly AL, Lucey JA,O’Mahony JA. Potential applications of nonbovine mammalian milk in infant nutrition. In: Park YW, Haenlein GFW, Wendorff WL, editors. Handbook of Milk of Non-Bovine Mammals. Oxford: JohnWiley & Sons, Ltd (2017). p. 625–54. doi: 10.1002/9781119110316.ch13
14. Potoˇcnik K, Gantner V, Kuterovac K, Cividini A. Mare’s milk: composition and protein fraction in comparison with different milk species. Mljekarstvo. (2011) 61:107–13. Available online at: https://hrcak.srce.hr/69078
15. Balthazar CF, Pimentel TC, Ferrão LL, Almada CN, Santillo A, Albenzio M, et al. Sheep milk: physicochemical characteristics and relevance for functional food development. Compr Rev Food Sci Food Saf. (2017) 16:247–62. doi: 10.1111/1541-4337.12250
16. Ranadheera CS, Evans CA, Baines SK, Balthazar CF, Cruz AG, Esmerino EA, et al. Probiotics in goat milk products: delivery capacity and ability to improve sensory attributes. Compr Rev Food Sci Food Saf. (2019) 18:867–82.doi: 10.1111/1541- 4337.12447
17. Barlowska J, Szwajkowska M, Litwinczuk Z, Krol J. Nutritional value and technological suitability of milk from various animal species used for dairy production. Compr Rev Food Sci Food Saf. (2011) 10:291–302. doi: 10.1111/j.1541-4337.2011.00163.x
18. Gantner V, Mijic P, Baban M, Skrtic Z, Turalija A. The overall and fat composition of milk of various species. Mljekarstvo. (2015) 65:223–31. doi: 10.15567/mljekarstvo.2015.0401
19. Claeys WL, Verraes C, Cardoen S, De Block J, Huyghebaert A, Raes K, et al. Consumption of raw or heated milk from different species: an evaluation of the nutritional and potential health benefits. Food Control. (2014) 42:188–201. doi: 10.1016/j.foodcont.2014.01.045
20. Arman P, Kay R, Goodall E, Sharman G. The composition and yield of milk from captive red deer (Cervus elaphus L.). J Reprod Fertil. (1974) 37:67–84. doi: 10.1530/jrf.0.0370067
21. Krzywi´nski A, Krzywi´nska K, Kisza J, Roskosz A, Kruk A.Milk composition, lactation and the artificial rearing of red deer. Acta Theriol. (1980) 25:341–7. doi: 10.4098/AT.arch.80-31
22. Landete-Castillejos T, Garcia A, Molina P, Vergara H, Garde J, Gallego L. Milk production and composition in captive Iberian red deer (Cervus elaphus hispanicus): effect of birth date. J Anim Sci. (2000) 78:2771–7. doi: 10.2527/2000.78112771x
23. Vithana NLO, Mason S, Bekhit A, Morton J. In vitro digestion of red deer (Cervus elaphus) and cow (Bos taurus) milk. Int Food Res J. (2012) 19:1367–74. Available online at: http://www.ifrj.upm.edu.my/19%20(04)%202012/10%20IFRJ%2019%20(04)%202012%20Nelum%20(074).pdf
24. Wang Y, Bekhit AEDA, Morton JD, Mason S. Nutritional value of deer milk. In: Watson RR, Collier RJ, Preedy V, editors. Nutrients in Dairy and their Implications for Health and Disease. 1st Edn. New York, NY: Academic Press (2017). p. 363–75. doi: 10.1016/B978-0-12-809762-5.00028-0
25. Martinez-Ferez A, Rudloff S, Guadix A, Henkel CA, Pohlentz G, Boza JJ, et al. Goats’ milk as a natural source of lactose-derived oligosaccharides: isolation by membrane technology. Int Dairy J. (2006) 16:173–81. doi: 10.1016/j.idairyj.2005.02.003
26. Li S, Ye A, Singh, H. Seasonal variations in composition, properties, and heat-induced changes in bovine milk in a seasonal calving system. J Dairy Sci. (2019) 102:7747–59. doi: 10.3168/jds.2019-16685
27. Oliveira DL, Wilbey RA, Grandison AS, Duarte LC, Roseiro LB. Separation of oligosaccharides from caprine milk whey, prior to prebiotic evaluation. Int Dairy J. (2012) 24:102–6. doi: 10.1016/j.idairyj.2011.12.012
28. Oliveira DL,Wilbey RA, Grandison AS, Roseiro LB.Milk oligosaccharides: a review. Int J Dairy Technol. (2015) 68:305–21. doi: 10.1111/1471-0307.12209
29. Roy D, Ye A, Moughan PJ, Singh, H. Gelation of milks of different species (dairy cattle, goat, sheep, red deer, and water buffalo) using glucono-d-lactone and pepsin. J Dairy Sci. (2020) 103:5844–62. doi: 10.3168/jds.2019-17571
30. Kappeler S. Compositional and structural analysis of camel milk proteins with emphasis on protective proteins. (thesis). Zurich, ETH Zurich (1998)
31. Tari NR, Fan MZ, Archbold T, Kristo E, Guri A, Arranz E, et al. Effect of milk protein composition of a model infant formula on the physicochemical properties of in vivo gastric digestates. J Dairy Sci. (2018) 101:2851–61. doi: 10.3168/jds.2017-13245
32. Ye A, Cui J, Carpenter E, Prosser C, Singh H. Dynamic in vitro gastric digestion of infant formulae made with goat milk and cow milk: influence of protein composition. Int Dairy J. (2019) 97:76–85. doi: 10.1016/j.idairyj.2019.06.002
33. Selo I, Clement G, Bernard H, Chatel J-M, Creminon C, Peltre G, et al. Allergy to bovine b-lactoglobulin: specificity of human IgE to tryptic peptides. Clin Exp Allergy. (1999) 29:1055–63. doi: 10.1046/j.1365-2222.1999.00612.x
34. Ereifej KI, Alu’datt MH, AlKhalidy HA, Alli I, Rababah T. Comparison and characterisation of fat and protein composition for camel milk from eight jordanian locations. Food Chem. (2011) 127:282–9. doi: 10.1016/j.foodchem.2010.12.112
35. El-Hatmi H, Jrad Z, Salhi I, Aguibi A, Nadri A, Khorchani T. Comparison of composition and whey protein fractions of human, camel, donkey, goat and cow milk. Mljekarstvo. (2015) 65:159–67. doi: 10.15567/mljekarstvo.2015.0302
36. Farah Z. Effect of heat treatment on whey proteins of camel milk. Milchwissenschaft. (1986) 41:763–65.
37. Beg OU, von Bahr-Lindström H, Zaidi ZH, Jörnvall H. Characterization of a heterogeneous camel milk whey non-casein protein. FEBS Lett. (1987) 216:270–74. doi: 10.1016/0014-5793(87)80704-4
38. Beg OU, von Bahr-Lindström H, Zaidi ZH, Jörnvall H. A small camelmilk protein rich in cysteine/half-cystine. Biosci Rep. (1984) 4:1065–70. doi: 10.1007/BF01116700
39. Park YW, Haenlein GFW. Other minor species milk (Reindeer, Caribou, Musk Ox, Llama, Alpaca, Moose, Elk, and Others). In: Park YW, Haenlein GFW, editors. Milk and Dairy Products in Human Nutrition. Oxford:Wiley-Blackwell Publishers (2013). p. 644–58. doi: 10.1002/9781118534168.ch30
40. De Kruif CG, Huppertz T, Urban VS, Petukhov AV. Casein micelles and their internal structure. Adv Colloid Interface Sci. (2012) 171:36–52. doi: 10.1016/j.cis.2012.01.002
41. InghamB, Smialowska A, KirbyN,Wang C, Carr A. A structural comparison of casein micelles in cow, goat and sheep milk using X-ray scattering. Soft Matter. (2018) 14:3336–43. doi: 10.1039/C8SM00458G
42. Nguyen HTH, Afsar S, Day L. Differences in the microstructure and rheological properties of low-fat yoghurts from goat, sheep and cow milk. Food Res Int. (2018) 108:423–9. doi: 10.1016/j.foodres.2018.03.040
43. Pierre A,Michel F, Le Graët Y, Zahoute L. Casein micelle size in relation with casein composition and as1, as2, b and k casein contents in goat milk. Lait. (1998) 78:591–605. doi: 10.1051/lait:1998653
44. Pierre A, Michel F, Le Graet, Y. Variation in size of goat milk casein micelles related to casein genotype. Lait. (1995) 75:489–502. doi: 10.1051/lait:1995638
45. Dalgleish DG. The basis of structure in dairy-based foods: casein micelles and their properties. In: Boland M, Golding M, Singh H, editors. Food Structures, Digestion and Health. Amsterdam: Elsevier (2014). p. 83–105. doi: 10.1016/B978-0-12-404610-8.00003-7
46. Wang P, Liu H, Wen P, Zhang H, Guo H, Ren F. The composition, size and hydration of yak casein micelles. Int Dairy J. (2013) 31:107–10. doi: 10.1016/j.idairyj.2013.02.007
47. Dewan RK, Bloomfield VA, Chudgar A, Morr CV. Viscosity and voluminosity of bovine milk casein micelles. J Dairy Sci. (1973) 56:699–705. doi: 10.3168/jds.S0022-0302(73)85236-1
48. Pellegrini O, Remeuf F, Rivemale M. Évolution des caractéristiques physicochimiques et des paramètres de coagulation du lait de brebis collecté dans la région de Roquefort. Lait. (1994) 74:425–42. doi: 10.1051/lait:1994635
49. Remeuf F, Lenoir J, Duby C, Letilly M-T, Normand A. Etude des relations entre les caractéristiques physico-chimiques des laits de chèvre et leur aptitude à la coagulation par la présure. Lait. (1989) 69:499–518. doi: 10.1051/lait:1989634
50. Ahmad S, Gaucher I, Rousseau F, Beaucher E, Piot M, Grongnet JF, et al. Effects of acidification on physico-chemical characteristics of buffalo milk: a comparison with cow’s milk. Food Chem. (2008) 106:11–17. doi: 10.1016/j.foodchem.2007.04.021
51. Luo J, Jian S, Wang P, Ren F, Wang F, Chen S, et al. Thermal instability and characteristics of donkey casein micelles. Food Res Int. (2019) 119:436–43. doi: 10.1016/j.foodres.2019.02.023
52. Beaucher E, Nogueira N, Camier B, Jardin J, Briard-Bion V, Musaad A, et al. Physico-chemical characteristics of fresh and corresponding pasteurized camel milks from intensive dairy farm in Saudi Arabia: 479. In: JAM 2013, ADSA–ASAS. Indianapolis, IN (2013).
53. Sood SM, Gaind DK, Dewan, R.K. Correlation between micelle salvation and calcium content. N Zeal J Dairy Sci. Technol. (1979) 14:32–44.
54. Remeuf F, Lenoir J. Relationship between the physico-chemical characteristics of goat’s milk and its rennetability. Bull Fédér Int Lait. (1986) 202:68–72.
55. Park YW. Rheological characteristics of goat and sheep milk. Small Rumin Res. (2007) 68:73–87. doi: 10.1016/j.smallrumres.2006.09.015
56. Park YW, Juarez M, Ramos M, Haenlein GFW. Physico-chemical characteristics of goat and sheep milk. Small Rumin Res. (2007) 68:88–113. doi: 10.1016/j.smallrumres.2006.09.013
57. Ceballos LS, Morales ER, de la Torre Adarve G, Castro JD, Martínez LP, SampelayoMRS. Composition of goat and cow milk produced under similar conditions and analyzed by identical methodology. J Food Compost Anal. (2009) 22:322–9. doi: 10.1016/j.jfca.2008.10.020
58. Ruiz-Sala P, Hierro M, Martinez-Castro I, Santa-Maria G. Triglyceride composition of ewe, cow, and goat milk fat. J Am Oil Chem Soc. (1996) 73:283–93. doi: 10.1007/BF02523421
59. Jenness R. Composition and characteristics of goat milk: review 1968–1979. J Dairy Sci. (1980) 63:1605–30. doi: 10.3168/jds.S0022-0302(80)83125-0
60. Abd El-Salam MH, El-Shibiny S. A comprehensive review on the composition and properties of buffalo milk. Dairy Sci Technol. (2011) 91:663. doi: 10.1007/s13594-011-0029-2
61. Kula JT, Tegegne D. Chemical composition and medicinal values of camel milk. Int J Res Stud Biosci. (2016) 4:13–25.
62. Park YW. Goat milk – chemistry and nutrition. In: Park YW, Haenlein GFW, editors. Handbook ofMilk of Non-BovineMammals.Oxford: Blackwell Publishing Professional (2008). p. 34–58. doi: 10.1002/9780470999738.ch3
63. Jandal J. Comparative aspects of goat and sheep milk. Small Rumin Res. (1996) 22:177–85. doi: 10.1016/S0921-4488(96)00880-2
64. German JB, Dillard CJ. Composition, structure and absorption of milk lipids: a source of energy, fat-soluble nutrients and bioactive molecules. Crit Rev Food Sci Nutr. (2006) 46:57–92. doi: 10.1080/10408690590957098
65. Stroebinger N. The effect of dietary calcium and other nutritionally relevant divalent cations on fatty acid-soap formation. (thesis). Manawatu: Massey University, Manawatu, New Zealand (2016).
66. Innis SM. Dietary triacylglycerol structure and its role in infant nutrition. Adv Nutr. (2011) 2:275–83. doi: 10.3945/an.111.000448
67. Singh H. The milk fat globule membrane—a biophysical system for food applications. Curr Opin Colloid Interface Sci. (2006) 11:154–63. doi: 10.1016/j.cocis.2005.11.002
68. Lopez C, Cauty C, Guyomarc’h F. Unraveling the complexity of milk fat globules to tailor bioinspired emulsions providing health benefits: the key role played by the biological membrane. Eur J Lipid Sci Technol. (2019)121:1800201. doi: 10.1002/ejlt.201800201
69. Lopez C, Madec M-N, Jimenez-Flores R. Lipid rafts in the bovine milk fat globule membrane revealed by the lateral segregation of phospholipids and heterogeneous distribution of glycoproteins. Food Chem. (2010) 120:22–33. doi: 10.1016/j.foodchem.2009.09.065
70. Nguyen HTH, Ong L, Hoque A, Kentish S, Williamson N, Ang C-S, et al. A proteomic characterization shows differences in the milk fat globule membrane of buffalo and bovine milk. Food Biosci. (2017) 19:7–16. doi: 10.1016/j.fbio.2017.05.004
71. Jenkins JA, Breiteneder H, Mills EN. Evolutionary distance from human homologs reflects allergenicity of animal food proteins. J Allergy Clin Immunol. (2007) 120:1399–405. doi: 10.1016/j.jaci.2007.08.019
72. El-Agamy EI. The challenge of cow milk protein allergy. Small Rumin Res. (2007) 68:64–72. doi: 10.1016/j.smallrumres.2006.09.016
73. Natale M, Bisson C, Monti G, Peltran A, Perono Garoffo L, Valentini S, et al. Cow’s milk allergens identification by two-dimensional immunoblotting and mass spectrometry. Mol Nutr Food Res. (2004) 48:363–9. doi: 10.1002/mnfr.200400011
74. Hinz K, O’Connor PM, Huppertz T, Ross RP, Kelly AL. Comparison of the principal proteins in bovine, caprine, buffalo, equine and camel milk. J Dairy Res. (2012) 79:185–91. doi: 10.1017/S0022029912000015
75. Businco L, Giampietro PG, Lucenti P, Lucaroni F, Pini C, Di Felice G, et al. Allergenicity of mare’s milk in children with cow’s milk allergy. J Allergy Clin. Immunol. (2000) 105:1031–4. doi: 10.1067/mai.2000.106377
76. Tesse R, Paglialunga C, Braccio S, Armenio L. Adequacy and tolerance to ass’s milk in an Italian cohort of children with cow’s milk allergy. Ital J Pediatr. (2009) 35:19. doi: 10.1186/1824-7288-35-19
77. Monti G, Bertino E, Muratore MC, Coscia A, Cresi F, Silvestro L, et al. Efficacy of donkey’s milk in treating highly problematic cow’s milk allergic children: an in vivo and in vitro study. Pediatr Allergy Immunol. (2007) 18:258–64. doi: 10.1111/j.1399-3038.2007.00521.x
78. EhlayelMS, Hazeima KA, Al-Mesaifri F, Bener A. Camel milk: an alternative for cow’s milk allergy in children. Allergy Asthma Proc. (2011) 32:255–8. doi: 10.2500/aap.2011.32.3429
79. El-Agamy EI, Nawar M, Shamsia SM, Awad S, Haenlein GF. Are camel milk proteins convenient to the nutrition of cow milk allergic children? Small Rumin Res. (2009) 82:1–6. doi: 10.1016/j.smallrumres.2008.12.016
80. Sheehan WJ, Phipatanakul W. Tolerance to water buffalo milk in a child with cow milk allergy. Ann Allergy Asthma Immunol. (2009) 102:349. doi: 10.1016/S1081-1206(10)60342-0
81. Restani P, Beretta B, Fiocchi A, Ballabio C, Galli CL. Cross-reactivity between mammalian proteins. Ann Allergy Asthma Immunol. (2002) 89:11–15. doi: 10.1016/S1081-1206(10)62116-3
82. Katz Y, Goldberg MR, Zadik-Mnuhin G, Leshno M, Heyman E. Crosssensitization between milk proteins: reactivity to a “kosher” epitope? Israel Med Assoc J. (2008) 10:85–8. Available online at: https://www.ima.org.il/MedicineIMAJ/viewarticle.aspxyear=2008&month=01&pag=85
83. Restani P, Gaiaschi A, Plebani A, Beretta B, Cavagni G, Fiocchi A, et al. Cross-reactivity between milk proteins from different animal species. Clin Exp Allergy. (1999) 29:997–1004. doi: 10.1046/j.1365-2222.1999.00563.x
84. Infante PD, Tormo CR, Conde ZM. Use of goat’s milk in patients with cow’s milk allergy. An Pediatr. (2003) 9:138–42.doi: 10.1016/s1695-4033(03)78737-2
85. Bellioni-Businco B, Paganelli R, Lucenti P, Giampietro PG, Perbornc H, Businco L. Allergenicity of goat’s milk in children with cow’s milk allergy. J Allergy Clin Immunol. (1999) 103:1191–4. doi: 10.1016/S0091-6749(99)70198-3
86. Robinson F. Goats milk – a suitable hypoallergenic alternative? Br Food J. (2001) 103:198–208. doi: 10.1108/00070700110386746
87. Spuergin P, Walter M, Schiltz E, Deichmann K, Forster J, Mueller H. Allergenicity of a-caseins from cow, sheep, and goat. Allergy. (1997) 52:293–8. doi: 10.1111/j.1398-9995.1997.tb00993.x
88. Martín TM, De La Hoz Caballer B, Lizana FM, Mendiola RG, Montano PP, Cano MS. Selective allergy to sheep’s and goat’s milk proteins. Allergol Immunopathol. (2004) 32:39–42. doi: 10.1157/13057769
89. Ah-Leung S, Bernard H, Bidat E, Paty E, Rance F, Scheinmann P, et al. Allergy to goat and sheep milk without allergy to cow’s milk. Allergy. (2006) 61:1358–65. doi: 10.1111/j.1398-9995.2006.01193.x
90. Bevilacqua C, Martin P, Candalh C, Fauquant J, Piot M, Roucayrol A-M, et al. Goats’ milk of defective as1-casein genotype decreases intestinal and systemic sensitization to b-lactoglobulin in guinea pigs. J Dairy Res. (2001) 68:217–27. doi: 10.1017/S0022029901004861
91. Rutherfurd SM, Fanning AC, Miller BJ, Moughan PJ. Protein digestibilitycorrected amino acid scores and digestible indispensable amino acid scores differentially describe protein quality in growing male rats. J Nutr. (2015)
145:372–9. doi: 10.3945/jn.114.195438
92. Bos C, Mahé S, Gaudichon C, Benamouzig R, Gausserès N, Luengo C, et al. Assessment of net postprandial protein utilization of 15 Nlabelled milk nitrogen in human subjects. Br J Nutr. (1999) 81:221–6. doi: 10.1017/S0007114599000410
93. Mahe S, Roos N, Benamouzig R, Davin L, Luengo C, Gagnon L, et al. Gastrojejunal kinetics and the digestion of [15N] beta-lactoglobulin and casein in humans: the influence of the nature and quantity of the protein. Am J Clin Nutr. (1996) 63:546–52. doi: 10.1093/ajcn/63.4.546
94. Boirie Y, Dangin M, Gachon P, Vasson M-P, Maubois J-L, Beaufrère B. Slow and fast dietary proteins differently modulate postprandial protein accretion. Proc Natl Acad Sci USA. (1997) 94:14930–5. doi: 10.1073/pnas.94.26. 14930
95. Dangin M, Boirie Y, Garcia-Rodenas C, Gachon P, Fauquant J, Callier P, et al. The digestion rate of protein is an independent regulating factor of postprandial protein retention. Am J Physiol Endocrinol Metab. (2001) 280:E340–8. doi: 10.1152/ajpendo.2001.280.2.E340
96. DanginM, Boirie Y, Guillet C, Beaufrère B. Influence of the protein digestion rate on protein turnover in young and elderly subjects. J Nutr. (2002) 132:3228S−33S. doi: 10.1093/jn/131.10.3228S
97. Pennings B, Boirie Y, Senden JM, Gijsen AP, Kuipers H, van Loon, et al.Whey protein stimulates postprandial muscle protein accretion more effectively than do casein and casein hydrolysate in older men. Am J Clin Nutr. (2011) 93:997–1005. doi: 10.3945/ajcn.110.008102
98. Fruhbeck G. Slow and fast dietary proteins. Nature. (1998) 391:843–5. doi: 10.1038/35993
99. Ye A, Roy D, Singh H. Structural changes to milk protein products during gastrointestinal digestion. In: Boland M, Singh H, editors. Milk Proteins. 3rd Edn. New York, NY: Academic Press (2020). p. 671–700. doi: 10.1016/B978-0-12-815251-5.00019-0
100. Mulet-Cabero A-I, Mackie AR, Brodkorb A, Wilde PJ. Dairy structures and physiological responses: a matter of gastric digestion. Crit Rev Food Sci Nutr. (2020). doi: 10.1080/10408398.2019.1707159. [Epub ahead of print].
101. HenschelMJ, NewportMJ, Parmar V. Gastric proteases in the human infant. Neonatology. (1987) 52:268–72. doi: 10.1159/000242719
102. Moschopoulou E. Characteristics of rennet and other enzymes from small ruminants used in cheese production. Small Rumin Res. (2011) 101:188–95. doi: 10.1016/j.smallrumres.2011.09.039
103. Guinee TP, Wilkinson MG. Rennet coagulation and coagulants in cheese manufacture. Int J Dairy Technol. (1992) 45:94–104. doi: 10.1111/j.1471-0307.1992.tb01791.x
104. Júnior BRCL, Tribst AAL, Cristianini M. High pressure homogenization of porcine pepsin protease: effects on enzyme activity, stability, milk coagulation profile and gel development. PLoS ONE. (2015) 10:e0125061. doi: 10.1371/journal.pone.0125061
105. CrabbeMJC. Rennets: general and molecular aspects. In: Fox PF,McSweeney PLH, Cogan TM, Guinee TP, editors. Cheese: Chemistry, Physics and Microbiology-Volume 1: General Aspects. 3rd Edn. Oxford: Academic Press (2004). p. 19–45. doi: 10.1016/S1874-558X(04)80061-7
106. Piper D, Fenton BH. pH stability and activity curves of pepsin with special reference to their clinical importance. Gut. (1965) 6:506–8. doi: 10.1136/gut.6.5.506
107. Ye A, Cui J, Dalgleish D, Singh, H. Formation of a structured clot during the gastric digestion of milk: impact on the rate of protein hydrolysis. Food Hydrocolloids. (2016) 52:478–86. doi: 10.1016/j.foodhyd.2015.07.023
108. Nakai S, Li-Chan E. Effect of clotting in stomachs of infants on protein digestibility of milk. Food Microstruct. (1987) 6:161–70.
109. Mason S. Some aspects of gastric function in the newborn. Arch Dis Child.
(1962) 37:387–91. doi: 10.1136/adc.37.194.387
110. de Oliveira SC, Bellanger A, Ménard O, Pladys P, Le Gouar Y, Dirson E, et al. Impact of human milk pasteurization on gastric digestion in preterm infants: a randomized controlled trial. Am J Clin Nutr. (2017) 105:379–90. doi: 10.3945/ajcn.116.142539
111. Moughan PJ, Rowan A. The pig as a model animal for human nutrition research. Proc Nutr Soc NZ. (1989) 14:116–23. doi: 10.1146/annurev.nu.07.070187.002045
112. Moughan PJ, Cranwell P, Darragh A, Rowan A. The domestic pig as a model animal for studying digestion in humans. Eur Assoc Anim Prod. (1994) 80:389.
113. Moughan PJ, Birtles M, Cranwell P, Smith W, Pedraza M. The piglet as a model animal for studying aspects of digestion and absorption in milk-fed human infants. World Rev Nutr Diet. (1992) 67:40–113. doi: 10.1159/000419461
114. Moughan PJ, Pedraza M, Smith WC, Williams M, Wilson MN. An evaluation with piglets of bovine milk, hydrolyzed bovine milk, and isolated soybean proteins included in infant milk formulas. I. effect on organ development, digestive enzyme activities, and amino acid digestibility. J Pediatr Gastroenterol Nutr. (1990) 10:385–94. doi: 10.1097/00005176-199004000-00020
115. Moughan PJ, Cranwell PD, Smith WC. An evaluation with piglets of bovine milk, hydrolyzed bovine milk, and isolated soybean proteins included in infant milk forumlas. II. stomach-emptying rate and the postprandial change in gastric pH and milk-clotting enzyme activity. J Pediatr Gastroenterol Nutr. (1991) 12:253–9. doi: 10.1097/00005176-199102000-00019
116. Darragh AJ, Moughan PJ. The amino acid composition of human milk corrected for amino acid digestibility. Br J Nutr. (1998) 80:25–34. doi: 10.1017/S0007114598001731
117. Washburn RM, Jones CH. Studies of the values of different grades of milk in infant feeding. Vermont Agric Exp Station Bull. (1916) 195:94–101. Available online at: https://babel.hathitrust.org/cgi/pt?id=uiug.30112019892352&view=1up&seq=11
118. Braude R, Newport MJ, Porter JW. Artificial rearing of pigs: 2. The time course of milk protein digestion proteolytic enzyme secretion in the 28-day-old pig. Br J Nutr. (1970) 24:827–42. doi: 10.1079/BJN19700086
119. Decuypere JA, Bossuyt R, Henderickx HK. Gastric secretion in suckling pigs and early-weaned pigs given a dry cow’s-milk formula ad lib. Br JNutr. (1978)
40:91–102. doi: 10.1079/BJN19780099
120. Lichan E, Nakai S. Rennin modification of bovine casein to simulate human casein composition – effect on acid clotting and hydrolysis by pepsin. Can Inst Food Sci Technol J. (1988) 21:200–8. doi: 10.1016/S0315-5463(88)70777-4
121. Lichan E, Nakai S. Enzymic dephosphorylation of bovine casein to improve acid clotting properties and digestibility for infant formula. J Dairy Res. (1989) 56:381–90. doi: 10.1017/S0022029900028843
122. Blakeborough P, Gurr MI, Salter DN. Digestion of the zinc in human milk, cow’s milk and a commercial babyfood: some implications for human infant nutrition. Br J Nutr. (1986) 55:209–17. doi: 10.1079/BJN19860027
123. Uniacke-Lowe T, Fox PF. Equid milk. In: Fuquay JW, Fox PF, McSweeney PLH, editors. Encyclopedia of Dairy Sciences. Vol. 3, 2nd Edn. San Diego, CA: Academic Press (2011). p. 518–29. doi: 10.1016/B978-0-12-374407-4.00318-6
124. Iannella G. Donkey cheese made through pure camel chymosin. Afr J Food Sci. (2015) 9:421–5. doi: 10.5897/AJFS2015.1322
125. Charfi I, Rezouga F,Makhlouf A, Bornaz S. The behaviour of Arabian donkey milk during acidification compared to bovine milk. Int J Dairy Technol. (2018) 71:439–45. doi: 10.1111/1471-0307.12447
126. Kamal M, Foukani M, Karoui R. Rheological and physical properties of camel and cow milk gels enriched with phosphate and calcium during acid-induced gelation. J Food Sci Technol. (2017) 54:439–46. doi: 10.1007/s13197-016-2480-9
127. Wang Y, Eastwood B, Yang Z, de Campo L, Knott R, Prosser C, et al. Rheological and structural characterization of acidified skim milks and infant formulae made from cow and goat milk. Food Hydrocolloids. (2019) 96:161–70. doi: 10.1016/j.foodhyd.2019.05.020
128. Ould Eleya MM, Desobry Banon S, Vetier N Hardy J. Rheological study of acid gels from cow, goat and sheep milks. Lait. (1998) 78:453–9. doi: 10.1051/lait:1998443
129. Gamble JA, Besley AK, Ellis NR. Composition and properties of goat’s milk as compared with cow’s milk. US Dept Agric Tech Bull. (1939) 671:1–72.
130. Genene A, Hansen EB, Eshetu M, Hailu Y, Ipsen R. Effect of heat treatment on denaturation of whey protein and resultant rennetability of camel milk. LWT. (2019) 101:404–9. doi: 10.1016/j.lwt.2018.11.047
131. Jasińska B. The comparison of pepsin and trypsin action on goat, cow, mare
and human caseins. Rocz Akad Med Bialymst. (1995) 40:486–93.
132. Hodgkinson AJ, Wallace OAM, Boggs I, Broadhurst M, Prosser CG. Gastric digestion of cow and goat milk: impact of infant and young child in vitro digestion conditions. Food Chem. (2018) 245:275–81. doi: 10.1016/j.foodchem.2017.10.028
133. Tagliazucchi D, Martini S, Shamsia S, Helal A, Conte A. Biological activities and peptidomic profile of in vitro-digested cow, camel, goat and sheep milk. Int Dairy J. (2018) 81:19–27. doi: 10.1016/j.idairyj.2018.01.014
134. Tagliazucchi D, Shamsia S, Helal A, Conte A. Angiotensinconverting enzyme inhibitory peptides from goats’ milk released by in vitro gastro-intestinal digestion. Int Dairy J. (2017) 71:6–16. doi: 10.1016/j.idairyj.2017.03.001
135. Rutella GS, Solieri L, Martini S, Tagliazucchi, D. Release of the antihypertensive tripeptides valine-proline-proline and isoleucine-prolineproline from bovine milk caseins during in vitro gastrointestinal digestion. J Agric Food Chem. (2016) 64:8509–15. doi: 10.1021/acs.jafc.6b03271
136. Maathuis A, Havenaar R, He T, Bellmann S. Protein digestion and quality of goat and cow milk infant formula and human milk under simulated infant conditions. J Pediatr Gastroenterol Nutr. (2017) 65:661–6. doi: 10.1097/MPG.0000000000001740
137. Almaas H, Cases A-L, Devold TG, Holm H, Langsrud T, Aabakken L, et al. In vitro digestion of bovine and caprine milk by human gastric and duodenal enzymes. Int Dairy J. (2006) 16:961–8. doi: 10.1016/j.idairyj.2005.10.029
138. El-Zahar K, Sitohy M, Choiset Y, Métro F, Haertlé T, Chobert J-M. Peptic hydrolysis of ovine b-lactoglobulin and a-lactalbumin. Exceptional susceptibility of native ovine b-lactoglobulin to pepsinolysis. Int Dairy J. (2005) 15:17–27. doi: 10.1016/j.idairyj.2004.06.002
139. Inglingstad RA, Devold TG, Eriksen EK, Holm H, Jacobsen M, Liland KH, et al. Comparison of the digestion of caseins and whey proteins in equine, bovine, caprine and human milks by human gastrointestinal enzymes. Dairy Sci Technol. (2010) 90:549–63. doi: 10.1051/dst/2010018
140. Mros S, Carne A, Ha M, Bekhit AE-D, Young W, McConnell, et al. Comparison of the bioactivity of whole and skimmed digested sheep milk with that of digested goat and cow milk in functional cell culture assays. Small Rumin Res. (2017) 149:202–8. doi: 10.1016/j.smallrumres.2017.02.018
141. Milan AM, Hodgkinson AJ, Mitchell SM, Prodhan UK, Prosser CG, Carpenter EA, et al. Digestive responses to fortified cow or goat dairy drinks: a randomised controlled trial. Nutrients. (2018) 10:1492. doi: 10.3390/nu10101492
142. Mills D. The in vitro buffering capacity of soluble paracetamol. Anaesthesia. (1989) 44:967–9. doi: 10.1111/j.1365-2044.1989.tb09197.x
143. Vaisman N, Reuven Y, Uzi M, Georgi G, Boehm G. Camel’s milk and gastric emptying. Clin Nutr. (2006) 25:622–5. doi: 10.1016/j.clnu.2006.02.011
144. Kong F, Singh RP. A human gastric simulator (HGS) to study food digestion in human stomach. J Food Sci. (2010) 75:E627–35. doi: 10.1111/j.1750-3841.2010.01856.x
145. Ye A, Liu W, Cui J, Kong X, Roy D, Kong Y, et al. Coagulation behaviour of milk under gastric digestion: effect of pasteurization and ultra-high temperature treatment. Food Chem. (2019) 286:216–25. doi: 10.1016/j.foodchem.2019.02.010
146. Schorsch C, Wilkins DK, Jones MG, Norton IT. Gelation of casein-whey mixtures: effects of heating whey proteins alone or in the presence of casein micelles. J Dairy Res. (2001) 68:471–81. doi: 10.1017/S0022029901004915
147. Dannenberg F, Kessler HG. Reaction kinetics of the denaturation of whey proteins in milk. J Food Sci. (1988) 53:258–63. doi: 10.1111/j.1365-2621.1988.tb10223.x
148. Kaufmann W. Influences of different technological treatments of milk on the digestion in the stomach. VI. estimation of amino acid and urea concentrations in the blood: conclusions regarding the nutritional evaluation. Milchwissenschaft. (1984) 39:281–4.
149. Lacroix M, Bon C, Bos C, Léonil J, Benamouzig R, Luengo C, et al. Ultra high temperature treatment, but not pasteurization, affects the postprandial kinetics of milk proteins in humans. J Nutr. (2008) 138:2342–7. doi: 10.3945/jn.108.096990
150. Doan FJ. Soft curd milk: a critical review of the literature. J Dairy Sci. (1938) 21:739–56. doi: 10.3168/jds.S0022-0302(38)93028-0
151. Ye A, Cui J, Dalgleish D, Singh H. The formation and breakdown of structured clots fromwhole milk during gastric digestion. Food Funct. (2016) 7:4259–66. doi: 10.1039/C6FO00228E
152. Ye A, Cui J, Dalgleish D, Singh H. Effect of homogenization and heat treatment on the behavior of protein and fat globules during gastric digestion of milk. J Dairy Sci. (2017) 100:36–47. doi: 10.3168/jds.2016-11764
153. Mulet-Cabero A-I, Mackie AR, Wilde PJ, Fenelon MA, Brodkorb A. Structural mechanism and kinetics of in vitro gastric digestion are affected by process-induced changes in bovine milk. Food Hydrocolloids. (2019) 86:172–83. doi: 10.1016/j.foodhyd.2018.03.035
154. Mulet-Cabero A-I, Torcello-Gómez A, Saha S, Mackie AR, Wilde PJ, Brodkorb A. Impact of caseins and whey proteins ratio and lipid content on in vitro digestion and ex vivo absorption. Food Chem. (2020) 319:126514. doi: 10.1016/j.foodchem.2020.126514
155. Mulet-Cabero A-I, Egger L, Portmann R, Ménard O, Marze S, Minekus M, et al. A standardised semi-dynamic in vitro digestion method suitable for food – an international consensus. Food Funct. (2020) 11:1702–20. doi: 10.1039/C9FO01293A
156. Ménard O, Bourlieu C, De Oliveira SCS, Dellarosa N, Laghi L, Carrière F, et al. A first step towards a consensus static in vitro model for simulating full-term infant digestion. Food Chem. (2018) 240:338–45. doi: 10.1016/j.foodchem.2017.07.145
157. Bourlieu C, Menard O, De La Chevasnerie A, Sams L, Rousseau F, Madec MN, et al. The structure of infant formulas impacts their lipolysis, proteolysis and disintegration during in vitro gastric digestion. Food Chem. (2015) 182:224–35. doi: 10.1016/j.foodchem.2015.03.001
158. Meena S, Rajput Y, Sharma R. Comparative fat digestibility of goat, camel, cow and buffalo milk. Int Dairy J. (2014) 35:153–6. doi: 10.1016/j.idairyj.2013.11.009
159. Alférez MJM, Barrionuevo M, López Aliaga I, Lisbona F, Robles JC, Campos MS, et al. Digestive utilization of goat and cow milk fat in malabsorption syndrome. J Dairy Res. (2001) 68:451–61. doi: 10.1017/S0022029901004903
160. Teng F, Reis MG, Yang L, Ma Y, Day L. Structural characteristics of triacylglycerols contribute to the distinct in vitro gastric digestibility of sheep and cow milk fat prior to and after homogenisation. Food Res Int. (2020) 130:108911. doi: 10.1016/j.foodres.2019.108911
161. Shani-Levi C, Alvito P, Andrés A, Assunção R, Barberá R, Blanquet-Diot S, et al. Extending in vitro digestion models to specific human populations: perspectives, practical tools and bio-relevant information. Trends Food Sci Technol. (2017) 60:52–63. doi: 10.1016/j.tifs.2016.10.017
Conflitto di interessi: gli Autori dichiarano che la ricerca è stata condotta in assenza di rapporti commerciali o finanziari che potrebbero essere interpretati come un potenziale conflitto di interessi.
Copyright © 2020 Roy, Ye, Moughan e Singh. Questo è un articolo open-access distribuito secondo i termini della Creative Commons Attribution License (CC BY). L’utilizzo, la distribuzione o la riproduzione in altre sedi sono consentiti, a condizione che vengano citati gli autori originali e i detentori del copyright e che venga citata la pubblicazione originale in questa rivista, in conformità con la pratica accademica accettata. Non è consentito alcun utilizzo, distribuzione o riproduzione non conforme a questi termini.