Premessa
Oggi molteplici studi dimostrano come il pascolo possa andare ad influenzare positivamente caratteristiche dietetico-nutrizionali del latte dei ruminanti. Infatti solo questo gruppo di mammiferi, con una corretta alimentazione ricca di alimento fresco, può produrre CLA: particolari acidi grassi, coniugati dell’acido linoleico, con riconosciute proprietà utili a mantenere un buono stato di salute del consumatore. Questi preziosi acidi grassi sono prodotti a livello ruminale e a livello mammario grazie all’azione di un enzima, la stearoyl-CoA desaturasi (SCD). Secondo alcuni autori l’espressione del gene dell’SCD potrebbe essere influenzata dalla presenza nel latte di microRNA, molecole endogene di RNA monofilamento non codificante. Il seguente studio ha quindi valutato come il pascolo possa influenzare l’espressione dei geni che codificano per l’SCD e per il miRNA 103 nel latte di capra.
Introduzione
La dieta dei ruminanti influenza in maniera significativa le caratteristiche dietetico-nutrizionali del latte, in particolare il profilo acidico del grasso [1]; ciò risulta molto importante alla luce degli effetti favorevoli sulla salute umana esplicati, soprattutto, da alcuni acidi grassi a lunga catena. Tra questi, i coniugati dell’acido linoleico (CLA), dei quali il più rappresentativo (> 80% dei CLA totali) è il cis-9, trans-11C18:2 o acido rumenico, posseggono proprietà immunomodulante, anti-cancerogena ed anti-aterosclerotica [2,3].
I CLA del latte provengono sia dall’attività dei batteri ruminali sugli acidi grassi insaturi della dieta, sia dall’azione della stearoyl-CoA desaturasi (SCD) mammaria sul trans-11 C18:1 (TVA, acido trans vaccenico), prodotto intermedio della bioidogenazione ruminale degli acidi grassi polinsaturi (PUFA). La SCD agisce anche sulla biosintesi degli acidi grassi monoinsaturi attraverso l’introduzione di un doppio legame tra i carboni in posizione 9 e 10 di alcuni acidi grassi saturi, in particolare il miristico (C14:0), il palmitico (C16:0) e lo stearico (C18:0). I microRNA (miRNA) sono molecole endogene di RNA non codificante a singolo filamento, contenute negli esosomi [4], resistenti alle alte temperature e alle condizioni di pH basso [5]; questa loro stabilità fa in modo che i lattanti ne possano assumere durante l’allattamento [6]. I miRNA del latte sono prodotti nella ghiandola mammaria e sono coinvolti nel metabolismo dei grassi [7]; secondo alcuni autori [8,9] la loro presenza influenzerebbe l’espressione del gene che codifica per l’SCD. Alcuni studi, infine, dimostrerebbero l’influenza della dieta [10] e in particolare dei PUFA in essa contenuta sul profilo dei miRNA sia nell’uomo [11] che nel ratto [12,13]. Alterazioni della normale espressione dei miRNA possono avere conseguenze sulla normale fisiologia cellulare e causare diversi tipi di patologie.
Da quanto sopra, agli autori del presente studio [14] è sembrato interessante valutare l’influenza dell’alimentazione al pascolo – ricco in PUFA, principalmente acido α-linolenico (C18:3, omega 3) e acido linoleico (C18:2, omega 6) – sull’espressione dei geni che codificano per l’SCD e per il miRNA 103 nel latte di capra.
Materiali, metodi e risultati
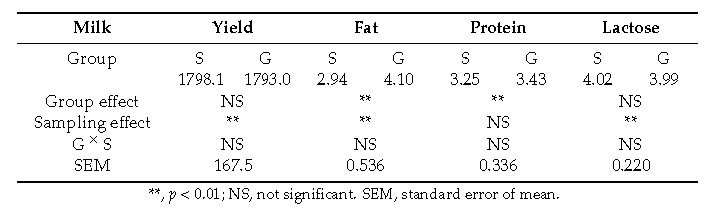
Allo scopo, 16 capre sono state suddivise subito dopo il parto (febbraio) in due gruppi (P, pascolo e S, stalla) omogenei per numero di parti e per produzione di latte nella precedente lattazione. I due gruppi hanno ricevuto un’eguale quantità di uno stesso concentrato ad integrazione, rispettivamente per il gruppo P e S, del pascolo o di fieno di medica. Dopo i primi 60 giorni, durante i quali il latte era destinato completamente ai capretti, la produzione quantitativa è stata misurata quotidianamente per 5 mesi e, mensilmente, sono stati prelevati e analizzati campioni individuali di latte. Analogamente, a cadenza mensile si è provveduto a determinare la composizione chimica ed il profilo acidico del pascolo. Sul latte si è provveduto anche, mediante PCR, a valutare l’espressione dei geni che codificano per l’SCD e per il miRNA 103. La quantità di latte prodotta non è risultata diversa tra i gruppi, mentre significativa è risultata la differenza, sempre a favore del gruppo allevato al pascolo, del suo contenuto in grasso (4.10% vs 2.94%; P<0.01) e proteine (3.43% vs 3.25%; P<0.05).
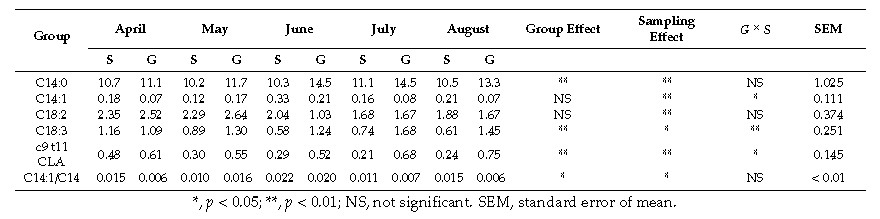
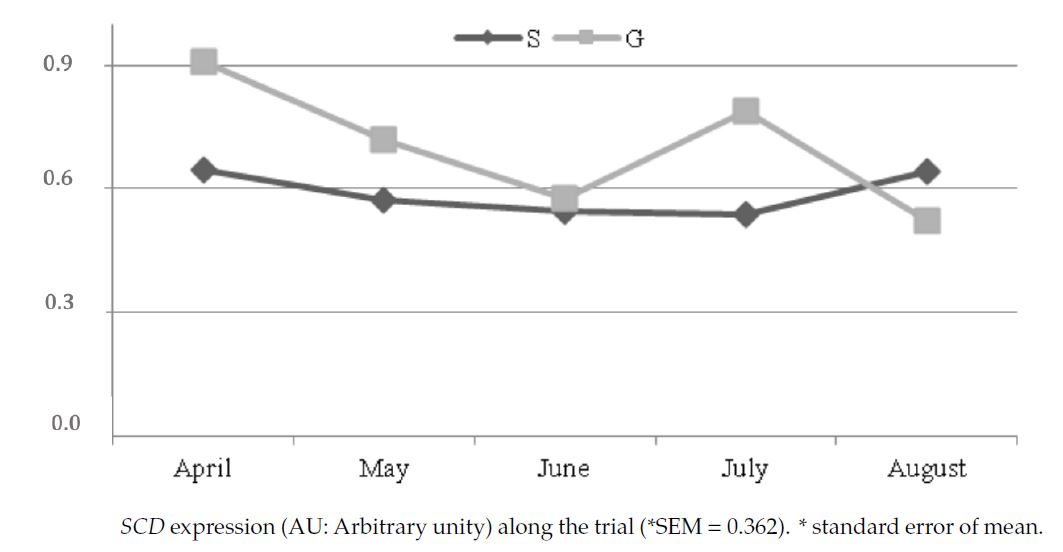
Il gruppo S ha mostrato livelli significativamente più alti di acidi grassi saturi (SFA) e più bassi di monoinsaturi (MUFA). Il gruppo P ha fatto registrare valori significativamente maggiori in C18:3 e omega 3 totali e un contenuto due volte più alto di CLA del gruppo S (0.646% vs 0.311%; P< 0.01), quest’ultimo parametro, in particolare nel mese di agosto, grazie ai più elevati livelli di acido α-linolenico (C18:3) e acido linoleico (C18:2) riscontrati nel pascolo. Questi acidi grassi, tuttavia, hanno influenzato in maniera differente l’espressione del SCD; infatti nel gruppo P essa è diminuita da aprile a giugno, aumentando a luglio ed agosto, mentre nel gruppo in stalla il livello è rimasto invariato per tutta la durata della sperimentazione. Nel mese di agosto i livelli di entrambi gli acidi C18:2 e C18:3 sono risultati elevati nel pascolo; significativo, rispetto ai mesi precedenti, è risultato solo l’incremento dell’acido linoleico, la qual cosa dimostrerebbe una maggiore influenza dei PUFA della serie omega 6 rispetto quelli della serie omega 3 sull’espressione del SCD.
Figura 1: Latte giornaliero prodotto (grammi per capo) e composizione chimica percentuale.
Figura 2: Profilo acidico dei grassi del latte durante la sperimentazione.
Figura 3: Espressione della SDC durante la sperimentazione.
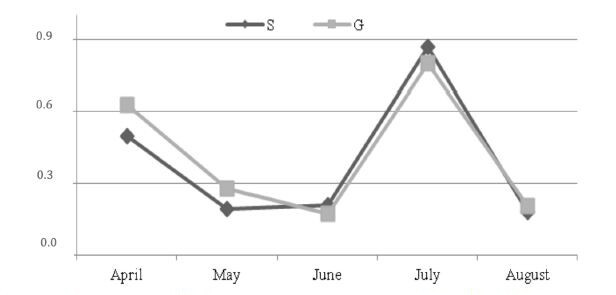
L’espressione di miRNA103 è stata simile in entrambi i gruppi, con una diminuzione da aprile a giugno, un aumento a luglio ed un crollo ad agosto.
Figura 4 – Espressione del miRNA 103 durante la sperimentazione.
Conclusioni
Il pascolo ha condizionato in maniera significativa il profilo acidico dei grassi in latte di capra; in particolare i livelli di CLA sono risultati sensibilmente aumentati nel latte di capre del gruppo P. Analogamente, la dieta può determinare variazioni dell’espressione del SCD, mentre quella del miRNA103 appare influenzata esclusivamente dallo stadio di lattazione.
Influence of Pasture on Stearoyl-CoA Desaturase and miRNA 103 Expression in Goat Milk: Preliminary Results
Raffaella Tudisco1, Valeria Maria Morittu2, Laura Addi1, Giuseppe Moniello3, Micaela Grossi1, Nadia Musco1*, Raffaella Grazioli1, Vincenzo Mastellone1, Maria Elena Pero1, Pietro Lombardi1° and Federico Infascelli1°
1) Department of Veterinary Medicine and Animal Production, University of Napoli Federico II,
80137 Napoli, Italy
2) Department of Health Sciences, Magna Graecia University of Catanzaro, 88100 Catanzaro, Italy
3) Department of Veterinary Medicine, University of Sassari, 07100 Sassari, Italy
* Correspondence: nadia.musco@unina.it
° These authors contributed equally to this work.
Animals 2019, 9(9), 606; https://doi.org/10.3390/ani9090606
Bibliografia
1) Chilliard, Y.; Ferlay, A.; Mansbridge, R.M.; Doreau, M. Ruminant milk fat plasticity: Nutritional control of saturated, polyunsaturated, trans and conjugated fatty acids. Ann. Zootech. 2000, 49, 181–205.
2) Pastuschenko, V.; Matthes, H.D.; Hein, T.; Holzer, Z. Impact of cattle grazing on meat fatty acid composition in relation to human nutrition. In Proceedings of the 13th International IFOAM Scientific Conference, Basel, Switzerland, 28–31 August 2000; Alföldi, T., Lockeretz, W., Niggli, U., Eds.; pp. 293–296.
3) Whigham, L.; Cook, M.E.; Atkinson, R.L. Conjugated linoleic acid: Implications for human health. Pharmacol. Res. 2000, 42, 503–510.
4) Reinhardt, T.A.; Lippolis, J.D.; Nonnecke, B.J.; Sacco, R.E. Bovine milk exosome proteome. J. Proteom. 2012, 75, 1486–1492.
5) Izumi, H.; Kosaka, N.; Shimizu, T.; Sekine, K.; Ochiya, T.; Takase, M. Bovine milk contains microRNA and messenger RNA that are stable under degradative conditions. J. Dairy Sci. 2012, 95, 4831–4841.
6) Gu, Y.; Li, M.; Wang, T.; Liang, Y.; Zhong, Z.; Wang, X.; Zhou, Q.; Chen, L.; Lang, Q.; He, Z.; et al. Lactation-Related MicroRNA Expression Profiles of Porcine Breast Milk Exosomes. PLoS ONE 2012, 7, e43691.
7) Lin, X.; Luo, J.; Zhang, L.; Zhu, J. MicroRNAs Synergistically Regulate Milk Fat Synthesis in Mammary Gland Epithelial Cells of Dairy Goats. Gene Expr. 2013, 16, 1–13.
8) Lin, X.; Luo, J.; Zhang, L.; Wang, W.; Gou, D. MiR-103 Controls Milk Fat Accumulation in Goat (Capra hircus) Mammary Gland during Lactation. PLoS ONE 2013, 8, e79258.
9) Lin, X.-Z.; Luo, J.; Zhang, L.P.; Wang, W.; Shi, H.B.; Zhu, J.J. miR-27a suppresses triglyceride accumulation and affects gene mRNA expression associated with fat metabolism in dairy goat mammary gland epithelial cells. Gene 2013, 521, 15–23.
10) Romao, J.M.; Jin, W.; He, M.; McAllister, T.; Guan, L.L. Altered MicroRNA Expression in Bovine Subcutaneous and Visceral Adipose Tissues from Cattle under Different Diet. PLoS ONE 2012, 7, e40605.
11) Circulating profiling reveals the effect of a polyunsaturated fatty acid-enriched diet on common microRNAs. J. Nutr. Biochem. 2015, 26, 1095–1101.
12) Davidson, L.A.; Wang, N.; Shah, M.S.; Lupton, J.R.; Ivanov, I.; Chapkin, R.S. n-3 Polyunsaturated fatty acids modulate carcinogen-directed non-coding microRNA signatures in rat colon. Carcinogenesis 2009, 30, 2077–2084.
13) Zheng, Z.; Ge, Y.; Zhang, J.; Xue, M.; Li, Q.; Lin, D.; Ma, W. PUFA diets alter the microRNA expression profiles in an inflammation rat model. Mol. Med. Rep. 2015, 11, 4149–4157.
14) Tudisco R., Morittu VM., Addi L., Moniello G., Grossi M., Musco N., Grazioli R., Mastellone V., Pero ME, Lombardi P., Infascelli F. (2019) Influence of Pasture on Stearoyl-CoA Desaturase and miRNA 103 Expression in Goat Milk: Preliminary Results. Animals, 9(9), 606.