Dagfinn Aune, Teresa Norat, Pål Romundstad, e Lars J Vatten
1Department of Public Health and General Practice, Faculty of Medicine, Norwegian University of Science and Technology, Trondheim, Norvegia (DA, PR, e LJV), e dal Department of Epidemiology and Biostatistics, School of Public Health, Imperial College London, Londra, Regno Unito (DA e TN).
2 Finanziato dalla Liaison Committee between the Central Norway Regional Health Authority (RHA) e dalla Norwegian University of Science and Technology (NTNU).
3 Inviare le richieste di ristampa e la posta a D Aune, Department of Epidemiology and Biostatistics, School of Public Health, Imperial College London, St Mary’s Campus, Norfolk Place, Paddington, Londra W2 1PG, Regno Unito.
E-mail: d.aune@imperial.ac.uk.
Ricevuto il 15 Gennaio 2013. Accettato per la pubblicazione il 22 Luglio 2013.
Prima pubblicazione online il 14 Agosto 2013; doi: 10.3945/ajcn.113.059030.
- Latticini totali
- Latticini ad elevato contenuto di grassi
- Latticini a basso contenuto di grassi
- Latte
- Formaggio
- Yogurt
- Altri prodotti lattiero-caseari
- Analisi di sottogruppo, di sensibilità e di meta-regressione
Abstract
Background: L’esistenza di una correlazione tra il consumo di latticini e il rischio di diabete di tipo 2 è stata presa in esame da numerosi studi, ma le prove ottenute risultano essere spesso inconcludenti.
Obiettivo: Abbiamo condotto una review sistematica aggiornata e una meta analisi dose-risposta sul consumo di latticini e il rischio di diabete di tipo 2.
Progetto dello studio: Abbiamo ricercato nel database PubMed studi prospettici caso-controllo e studi caso-controllo nested relativi al consumo di latticini e al rischio di diabete di tipo 2, con data al 5 Giugno 2013. I RR complessivi sono stati stimati utilizzando un modello ad effetti random.
Risultati: Nella meta-analisi sono stati inclusi 17 studi di coorte. Nelle analisi dose-risposta, i RR complessivi ( IC 95%) erano: 0.93 (0.87, 0.99; I2 = 33%) per 400 g di latticini totali/die (n = 12), 0.98 (0.94, 1.03; I2 = 8%) per 200 g di latticini ad elevato contenuto di grassi/die (n = 9 ), 0.91 (0.86, 0.96; I2 = 40%) per 200 g di latticini magri/die (n = 9), 0.87 (0.72, 1.04; I2 = 94%) per 200 g di latte/die (n = 7 ), 0.92 (0.86, 0.99; I2 = 0%) per 50 g di formaggio/die (n = 8) e 0.78 (0.60, 1.02; I2 = 70%) per 200 g di yogurt/die (n = 7). Correlazioni inverse non lineari sono state osservate per i latticini totali (P non lineare, < 0.0001), per i latticini a basso contenuto di grassi (P = 0.06), per il formaggio (P = 0.05) e per lo yogurt (P = 0.004), ed era evidente un appiattimento della curva relativa ai livelli più alti di assunzione.
Conclusioni: Questa meta-analisi suggerisce l’esistenza di una significativa correlazione inversa tra il consumo di latticini, di latticini magri, di formaggio e il rischio di diabete di tipo 2. Eventuali studi aggiuntivi dovrebbero valutare l’esistenza di una correlazione anche tra altre specifiche tipologie di prodotti lattiero-caseari e il rischio di diabete di tipo 2, ed effettuare le correzioni per i potenziali fattori confondenti.
Introduzione
La prevalenza del diabete di tipo 2 sta aumentando rapidamente in tutto il mondo, di pari passo con l’aumento dell’obesità, con la diminuzione dell’attività fisica e con il cambiamento delle abitudini alimentari. Nel 2011 è stato stimato che 366 milioni di persone fossero affette da diabete (prevalentemente di tipo 2) e si prevede che questo numero andrà ad aumentare fino a raggiungere i 552 milioni entro il 2030 (1). Sebbene la tipologia di dieta adottata sia da considerarsi molto importante in relazione all’aumento della prevalenza del diabete di tipo 2, poche tipologie di alimenti vengono considerate come fattori di rischio per il diabete di tipo 2 (2-5). Si ritiene che i latticini siano in grado di proteggere dalla comparsa del diabete di tipo 2, visto il loro elevato contenuto di calcio, magnesio, vitamina D e proteine (presenti nel siero di latte), che possono favorire la diminuzione del grasso corporeo e dell’insulino resistenza (6). Tuttavia, alcuni prodotti lattiero-caseari (come formaggio e panna) hanno anche un elevato contenuto di grassi, e ciò potrebbe andare a vanificare qualsiasi beneficio derivante dall’aumento dell’apporto di calcio o di altre componenti potenzialmente utili presenti in questi prodotti. Gli studi epidemiologici mostrano risultati contrastanti: alcuni suggeriscono una diminuzione del rischio associato ad un aumento del consumo di latticini (7-14), mentre altri studi non suggeriscono l’esistenza di alcuna correlazione (15-23). Anche studi condotti su specifiche tipologie di prodotti caseari hanno dato risultati contrastanti: alcuni hanno riportato la presenza di correlazioni inverse per i latticini a basso contenuto di grassi (7, 10, 13, 15, 19), il latte (12, 16), il latte magro o scremato ( 7, 10, 14), il formaggio (10, 14, 21) e lo yogurt (7, 10, 19, 21), mentre altri studi suggerivano l’assenza di qualsiasi correlazione (8, 17, 18, 20, 22-24). D’altro canto, la maggior parte degli studi condotti sui latticini ad elevato contenuto di grassi non riportava l’esistenza di alcuna correlazione (7, 8, 10, 13, 15, 20, 24) e solo uno studio riportava un rischio ridotto (23). La correlazione dose-risposta tra latticini e diabete di tipo 2 richiede un’analisi più dettagliata per stabilire se possano esserci potenziali effetti soglia. Inoltre, è importante stabilire se le correlazioni differiscono in base alla tipologia di prodotto lattiero-caseario consumato e ad alcune caratteristiche specifiche dello studio come la posizione geografica e la correzione dei fattori di confondimento. Per fare chiarezza sull’esistenza di una correlazione tra il consumo di latticini e il rischio di diabete di tipo 2, abbiamo condotto una review sistematica ed una meta analisi degli studi prospettici a nostra disposizione. L’obiettivo specifico era quello di analizzare le differenti tipologie di prodotti caseari, per valutare se la correlazione cambiasse in base alle caratteristiche dello studio e per meglio evidenziare qualsiasi correlazione dose-risposta esistente tra il consumo di latticini e il rischio di diabete di tipo 2.
Metodi
Strategia di ricerca
Abbiamo esaminato il database PubMed (www.ncbi.nlm.nih.gov/pubmed) con data fino al 5 giugno 2013 cercando gli studi di coorte relativi al consumo di latticini e al rischio di diabete di tipo 2. Come parte di un’ampia review sistematica sugli aspetti dietetici e sul rischio di diabete di tipo 2, abbiamo utilizzato numerosi termini di ricerca relativi a questo argomento. I termini adottati erano i seguenti: cereale O grano O cereali O riso O pane O radici O tuberi O verdura O frutta O legume O legumi O fagiolo O fagioli O lenticchia O lenticchie O leguminosa O leguminose O soia O di soia O piselli O ceci O cecio O frutta a guscio O semi O arachide O arachidi O carne O carne bovina O carne di maiale O agnello O pollame O pollo O pesce O uovo O uova O frutti di mare O crostacei O latticini O prodotti lattiero-caseari O latte O formaggio O yogurt O gelato O burro O bevanda O bevande O bibita O bibita gassata O bibite gassate O succo O succhi O punch O alimenti E diabete. Abbiamo ricercato anche la lista dei riferimenti delle review precedenti riguardanti questo argomento (25-28) e degli studi inclusi nell’analisi per qualsiasi ulteriore studio futuro.
Selezione dello studio
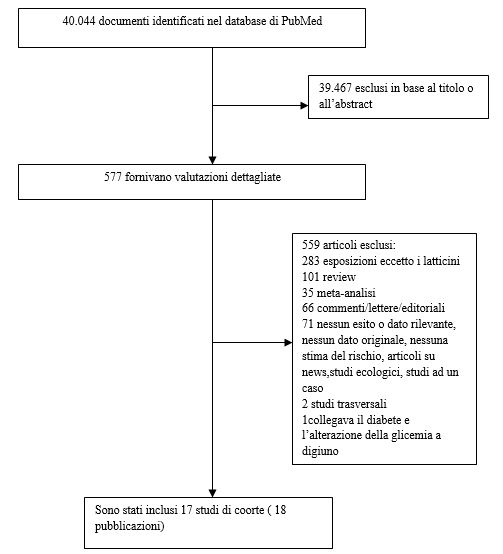
Per essere incluso, lo studio doveva essere del tipo prospettico di coorte, caso-controllo o doveva essere uno studio caso-controllo nested e doveva analizzare l’esistenza di una correlazione tra il consumo di latticini e il rischio di diabete di tipo 2. Le stime del RR (HR, risk ratio, OR) dovevano essere disponibili con un IC del 95% e per l’analisi dose-risposta era necessario conoscere, se presente nella pubblicazione oppure su richiesta degli autori, la misura quantitativa del consumo e il numero totale di casi e di persone-anni. Abbiamo identificato 22 studi potenzialmente rilevanti (7-24, 29-32). Uno studio è stato escluso essendo di tipo trasversale (31), due studi non riportavano alcuna stima del rischio per il diabete di tipo 2 (29, 30) e uno studio è stato escluso perché riportava come esiti comuni un alterato aumento della glicemia a digiuno e il diabete di tipo 2 (32). L’European Investigation into Cancer and Nutrition (EPIC)-Potsdam Study (24) prendeva in esame differenti tipologie di alimenti di derivazione lattiero-casearia rispetto allo studio EPIC-InterAct (21), per questo è stato incluso nonostante alcune sovrapposizioni tra questi due studi.
Estrazione dei dati
Da ogni studio abbiamo estratto i seguenti dati: cognome del primo autore, anno di pubblicazione, paese in cui è stato condotto lo studio, nome dello studio, periodo di follow-up, dimensione del campione, sesso, età, numero di casi, metodo di valutazione della dieta (tipologia , numero di alimenti e se convalidato), esposizione, quantità consumata, RR e IC al 95% per i più alti livelli di assunzione rispetto a quelli più bassi e le variabili corrette durante l’analisi.
Metodi statistici
Abbiamo utilizzato modelli ad effetti random per calcolare i RR complessivi e gli IC al 95% per i più alti livelli consumati di latticini versus quelli più bassi e per le analisi dose-risposta (33). È stata stimata la media del logaritmo naturale dei RR, e quelli di ogni studio sono stati ponderati mediante l’inverso della loro varianza. Un P value a due code < 0.05 veniva considerato significativo. Per uno studio che riportava separatamente i risultati riguardanti gli uomini e le donne (18), quindi non nel complesso, abbiamo combinato i risultati utilizzando un modello ad effetti fissi per ottenere una stima per entrambi i sessi insieme, da utilizzare nell’analisi complessiva. Abbiamo utilizzato il metodo descritto da Greenland e Longnecker (34) per l’analisi dose-risposta e per calcolare le pendenze specifiche dello studio (trend lineari) e gli IC al 95%, a partire dal logaritmo naturale degli RR e degli IC delle varie categorie di consumo dei latticini. Il metodo richiede che sia nota la distribuzione dei casi (o l’assenza di casi) e le persone-anni, e gli RR con le stime della varianza per almeno 3 categorie di esposizione quantitativa. Negli studi che non presentavano tali dati, ma che riportavano almeno il numero totale di casi/persone-anni, abbiamo provveduto a stimare la distribuzione dei casi o delle persone-anni (35). La quantità mediana o media del consumo di latticini per ogni categoria di assunzione è stata assegnata al corrispondente RR per ogni studio. Per quanto riguarda gli studi che riportavano l’assunzione di latticini in base agli intervalli di consumo, abbiamo stimato il punto centrale di ciascuna categoria di assunzione calcolando la media del limite inferiore e di quello superiore. Quando la categoria più alta o più bassa risultavano illimitate, abbiamo supposto che la lunghezza dell’intervallo illimitato fosse uguale alla lunghezza dell’intervallo adiacente. Negli studi che riportavano i consumi in base alla frequenza, abbiamo stabilito come porzione 43 g per il formaggio, 177 g per i latticini totali e 244 g per il latte e lo yogurt, per poter ricalcolare i consumi attraverso una scala comune (g/die) (36). Abbiamo valutato una potenziale correlazione non lineare dose-risposta tra il consumo di latticini e il diabete di tipo 2 utilizzando modelli polinomiali frazionari (37). Abbiamo determinato il modello di regressione polinomiale frazionario di secondo ordine più adatto, definito come quello con la devianza più bassa. Per valutare la non linearità (37) è stato utilizzato un test del rapporto di verosimiglianza per determinare le differenze tra i modelli non lineari e quelli lineari. Il consumo nella categoria di riferimento è stato sottratto dal consumo in ogni categoria per l’analisi lineare dose-risposta, ma non per l’analisi non lineare dose-risposta. Per tre studi era necessario avere informazioni supplementari (9, 14, 16) che sono state ottenute per 2 di essi (14, 16). L’eterogeneità tra gli studi è stata valutata dal test Q e I2 (38). I2 è il tasso di variazione totale spiegato dalla varianza tra gli studi. Valori di I2 del ~ 25%, 50% e 75% indicano, rispettivamente, una bassa, una media ed una elevata eterogeneità. Per studiare le fonti dell’eterogeneità, abbiamo condotto analisi di sottogruppo e di meta-regressione stratificate in base a caratteristiche proprie dello studio come sesso, durata del follow-up, numero di casi e correzione per fattori di confondimento. I bias di pubblicazione sono stati valutati mediante il test di Egger (39), e quando i risultati mostravano un P < 0.10 eravamo di fronte alla presenza di bias di pubblicazione. Abbiamo condotto analisi di sensibilità escludendo uno studio alla volta, per garantire che i risultati non fossero dovuti semplicemente alla grandezza dello studio o ad uno studio con un risultato al limite. I risultati di queste analisi di sensibilità sono stati presentati andando ad escludere due studi, quello con il massimo impatto negativo e quello con il massimo impatto positivo sulle stime complessive. Le analisi statistiche sono state condotte utilizzando Stata, versione 10.1 (StataCorp).
Risultati
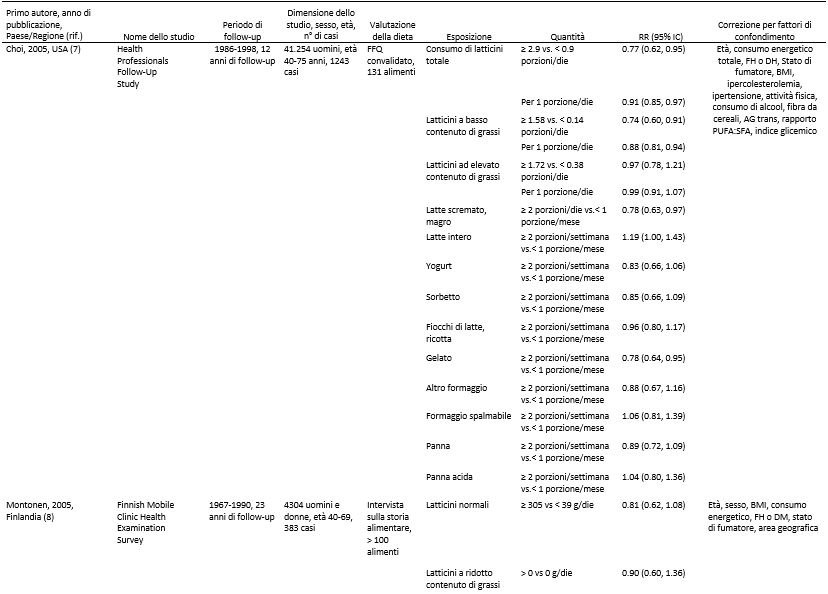
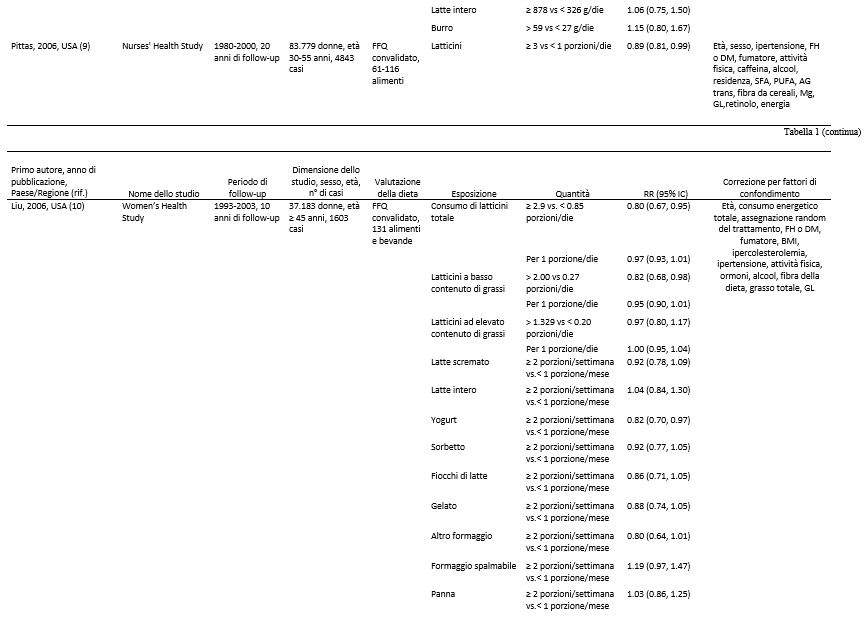
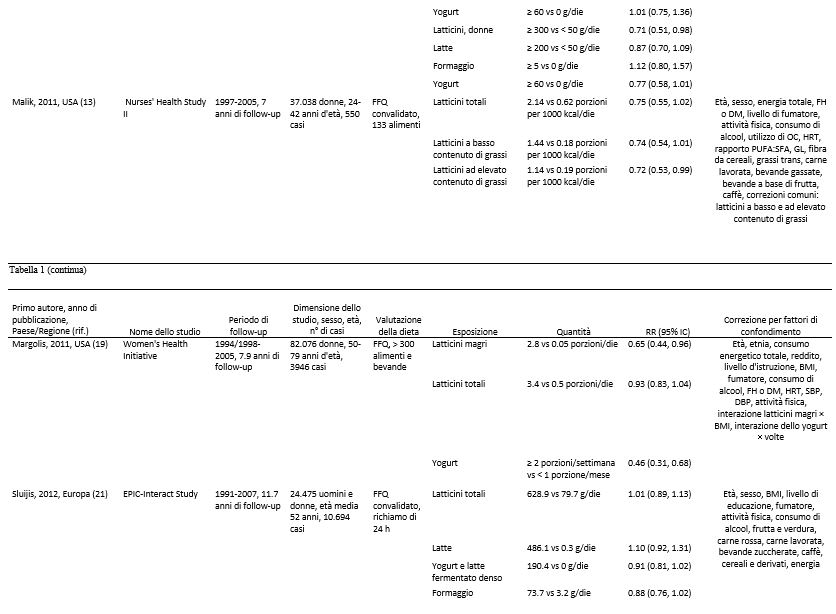
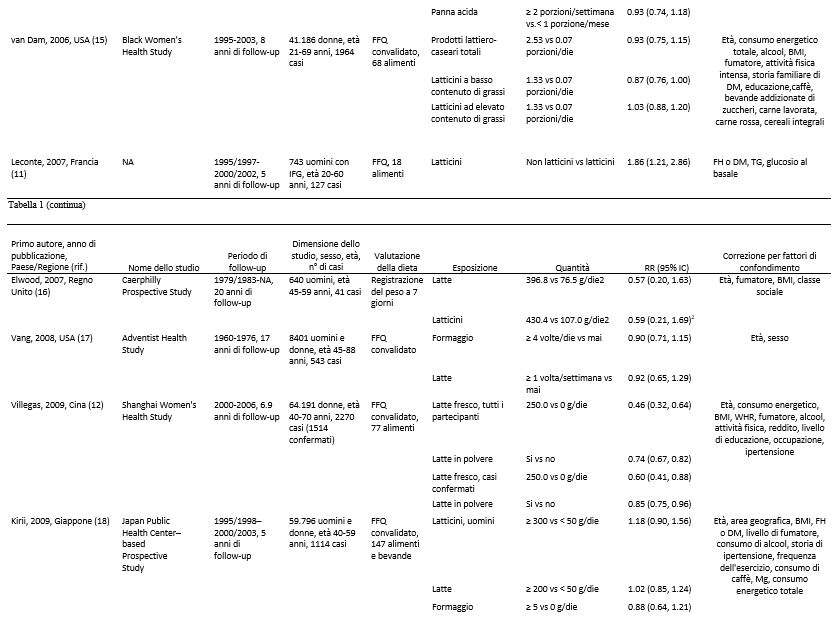
Abbiamo identificato 17 studi di coorte (18 pubblicazioni) (7-24) che potevano essere inclusi nell’analisi. Tutti gli studi sono stati inseriti nella meta analisi che confrontava quella più alta con quella più bassa (7-23) e 15 studi di coorte (16 pubblicazioni) (7, 8, 10, 12-24) potevano essere inclusi nella meta analisi dose-risposta ( Tabella 1 e Figura 1). Sette studi provenivano dagli Stati Uniti, 6 dall’Europa, 2 dall’Asia e 2 dall’Australia (Tabella 1).
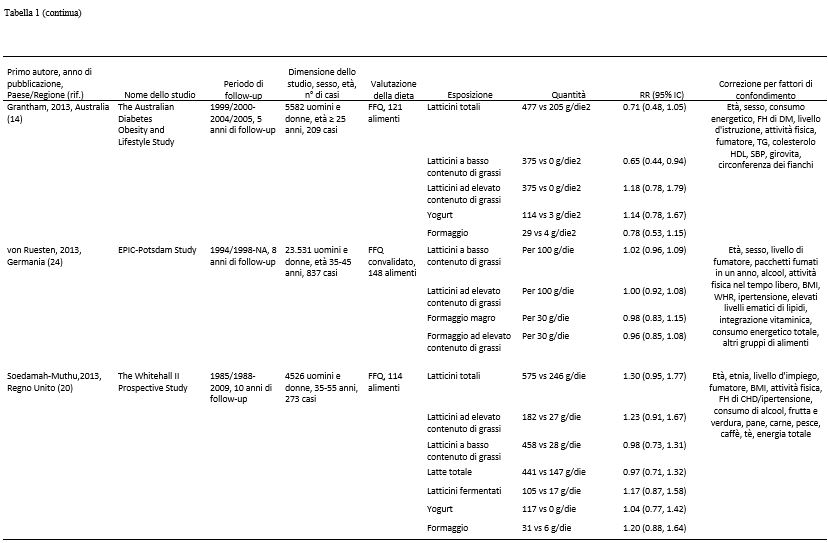
Tabella 1. Studi prospettici di coorte sul consumo di latte e latticini e il rischio di diabete di tipo 2.1
Clicca sulla tabella per ingrandire
1 CHD, patologia cardiaca coronarica; DBP, pressione ematica diastolica; DM, diabete mellito; DM2, diabete mellito di tipo 2; EPIC, European prospective Investigation into Cancer and Nutrition; FA, acidi grassi; FFQ, questionario di frequenza alimentare; FH, storia familiare; GL, indice glicemico; HRT, terapia ormonale di sostituzione; IFG, alterata glicemia a digiuno; NA, non disponibile; OC, contraccettivo orale; ref. riferimenti; SBP, pressione ematica sistolica; TG, trigliceridi; WHR, rapporto girovita:fianchi.
2 Sulla base di supplementari informazioni fornite dagli Autori.
Figura 1. Diagramma di flusso relativo alla selezione degli studi. www.ncbi.nlm.nih.gov/pubmed
Latticini totali
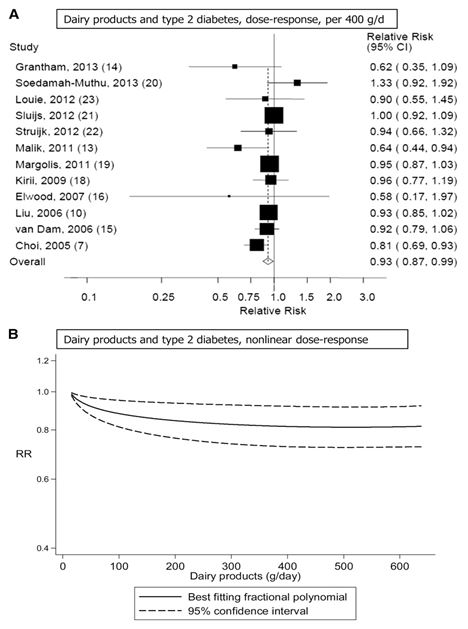
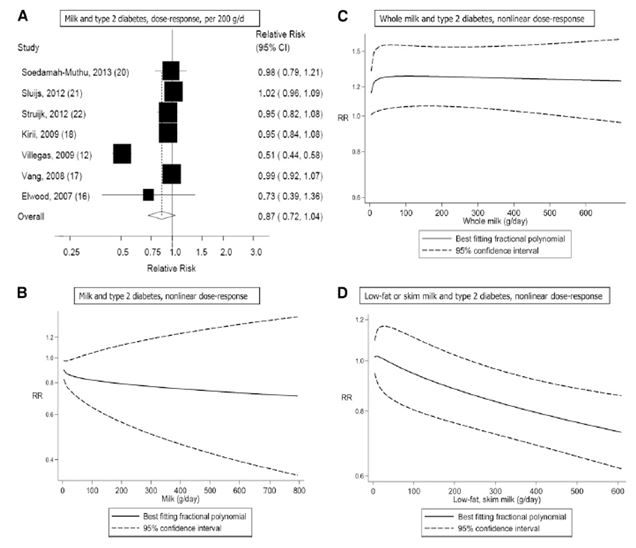
Quattordici studi di coorte (7, 9-11, 13-16, 18-23) analizzavano la correlazione esistente tra il consumo di latticini totali e il rischio di diabete di tipo 2 e comprendevano 26.976 casi tra tutti i 426.055 partecipanti. Dodici di questi studi sono stati inclusi nell’analisi dose-risposta (7, 9 11, 13-16, 18-23) e due studi sono stati esclusi perché riportavano risultati relativi soltanto ad elevati e bassi confronti (9, 11). Il RR complessivo del consumo più alto rispetto a quello più basso era 0.89 (IC 95%: 0.82, 0.96), con moderata eterogeneità tra gli studi (I2 = 42.1% e eterogeneità P = 0.05) (vedere la Figura S1 supplementare in “Dati supplementari” nell’articolo online). Il RR complessivo per 400 g/die era 0.93 (IC 95%: 0.87, 0.99, I2 = 33.1% e eterogeneità P = 0.13) (Figura 2A). Nelle analisi di sensibilità (escludendo dall’analisi uno studio alla volta) i RR complessivi per il diabete di tipo 2 variavano da 0.91 (IC 95%: 0.85, 0.97) quando è stato escluso lo studio EPIC-Interact (21), a 0.95 (IC 95%: 0.90, 1.00) quando è stato escluso l’Health Professional Follow-Up Study (7). Non vi era alcuna indicazione di bias di pubblicazione secondo il test di Egger (P = 0.20). Era evidente la presenza di una correlazione non lineare tra il consumo di latticini e il diabete di tipo 2, e la maggior parte del beneficio è stata osservata aumentando il consumo partendo da basse quantità (non linearità di P < 0.0001). Inoltre non si verificava un’ulteriore diminuzione del rischio con consumi al di sopra dei 300- 400 g/giorno (vedere la Figura 2B e la Tabella supplementare S1 in “Dati supplementari” nel numero online).
Figura 2. A, B: Consumo di latticini totali e rischio di diabete di tipo 2. Il RR complessivo utilizzando modelli ad effetti random per 400g/die era 0.93 ( IC 95% : 0.87, 0.99; I 2= 33.1%; eterogeneità di P = 0.13; n = 341.533). C’erano prove di una correlazione non lineare tra i latticini totali e il rischio di diabete di tipo 2, non linearità di P < 0.0001.
Latticini ad elevato contenuto di grassi
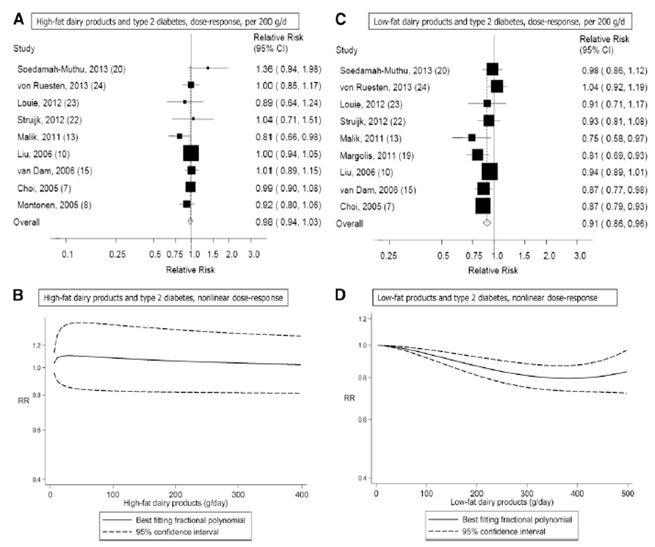
Nove studi di coorte (7, 8, 10, 13, 15, 20, 22-24) analizzavano l’esistenza di una correlazione tra il consumo di latticini ad elevato contenuto di grassi e il rischio di diabete di tipo 2 e includevano 7222 casi tra i 196.799 partecipanti. Uno di questi studi è stato incluso soltanto nell’analisi dose-risposta perché riportava un risultato continuo (24). Il RR complessivo di un consumo più alto rispetto ad uno più basso era di 0.96 (IC 95%: 0.87, 1.06; I2 = 15.8% e eterogeneità P = 0.31) (vedere la Figura S2 supplementare in “Dati supplementari” nel numero online). Il RR complessivo per 200 g/die era 0.98 (IC 95%: 0.94, 1.03, I2 = 7.6% e eterogeneità P = 0.37) (Figura 3A). I RR complessivi erano compresi tra 0.97 (IC 95%: 0.91, 1.03) quando è stato escluso il Women’s Health Study (10) e 0.99 (IC 95%: 0.96, 1.03) quando è stato escluso il Nurse’s Health Study II (13). Non c’erano prove dell’esistenza di bias di pubblicazione (P = 0.77), e non c’erano prove di una correlazione non lineare (non linearità di P = 0.57) (Figura 3B e Tabella Supplementare S2 in “Dati supplementari” nel numero online).
Latticini a basso contenuto di grassi
Dieci studi di coorte (7, 8, 10, 13, 19, 20, 22-24) sono stati inclusi nell’analisi riguardante i latticini a basso contenuto di grassi e il diabete di tipo 2 e comprendevano 11.168 casi tra i 278.875 partecipanti. Nove di questi studi sono stati inclusi nell’analisi dose-risposta (7, 10, 13, 15, 19, 20, 22-24). Uno di questi studi è stato escluso dall’analisi dose-risposta poiché i risultati presentati riguardavano solo 2 categorie (8) ed uno studio è stato escluso dall’analisi che metteva a confronto i livelli più elevati con quelli più bassi di consumo perché presentava solo risultati continui (24). Il RR complessivo relativi alla categoria di consumo più alto rispetto a quello più basso era di 0.83 (IC 95%: 0.76, 0.90, I2 = 0% e eterogeneità di P = 0.67) (vedere la Figura S3 supplementare in “Dati supplementari” nel numero online). Il RR complessivo per 200 g/die era 0.91 (IC 95%: 0.86, 0.96, I2 = 40.2% e eterogeneità di P = 0.10) (Figura 3C). I RR complessivi erano compresi tra 0.90 (IC 95%: 0.85, 0.94) quando è stato escluso l’EPIC-Potsdam Study (24) e 0.92 (IC 95%: 0.87, 0.97) quando è stato escluso il Women’s Health Initiative Observational Study (19). Non c’erano prove della presenza di bias di pubblicazione (P = 0.49). C’erano alcune indicazioni di una correlazione non lineare tra i latticini a basso contenuto di grassi e il diabete di tipo 2 (non linearità di P = 0.06), e l’assenza di un’ulteriore diminuzione del rischio sopra i 300-400 g/die consumati (vedi Figura 3D e Tabella Supplementare S3 in “Dati Supplementari” nel numero online).
Figura 3. A-D: Consumo di latticini ad elevato e a basso contenuto di grassi e rischio di diabete di tipo 2. I RR complessivi utilizzando modelli ad effetti random per 200 g/die erano 0.98 (IC 95%: 0.94, 1.03; I2 = 7.6%; eterogeneità di P = 0.37; n = 196.779) per i latticini ad elevato contenuto di grassi (A) e 0.91 (IC 95%: 0.86, 0.96; I 2 = 40.2 %; eterogeneità di P = 0.10; n = 274.571) per i latticini a basso contenuto di grassi (C). C’era l’indicazione di una correlazione non lineare tra i latticini a basso contenuto di grassi e il diabete di tipo 2 ( non linearità di P = 0.06) (D), ma non tra i latticini ad elevato contenuto di grassi e il diabete di tipo 2 (non linearità di P = 0.57) (B).
Latte
Sette studi di coorte (12, 16-18, 20-22) sono stati inclusi nell’analisi che confrontava il consumo di latte elevato con quello più moderato e il rischio di diabete di tipo 2 e comprendevano un totale di 15.149 casi tra i 167.982 partecipanti. Il RR complessivo era di 0.87 (IC 95%: 0.70, 1.07) e c’era un’elevata eterogeneità (I2 = 70.5%; eterogeneità P = 0.002) (vedere la Figura S4 supplementare in “Dati supplementari” nel numero online). Il RR complessivo per 200 g/die era 0.87 (IC 95%: 0.72, 1.04) e c’era un’eterogeneità molto elevata (I2 = 93.6%; Eterogeneità di P < 0.0001) (Figura 4A). Nelle analisi di sensibilità, i RR complessivi del diabete di tipo 2 variavano da 0.84 (IC 95%: 0.66, 1.06) quando è stato escluso lo studio EPIC-Interact (21), a 0.99 (IC 95%: 0.95, 1.04) quando è stato escluso lo Shanghai Women’s Health Study (12). L’eterogeneità è diminuita quando anche il secondo studio è stato escluso (I2 = 0% e eterogeneità P = 0.76). Non c’era alcuna indicazione della presenza di bias di pubblicazione secondo il test di Egger (P = 0.41). C’erano le prove dell’esistenza di una correlazione inversa non lineare tra il consumo di latte e il diabete di tipo 2 (non linearità di P < 0.0001); tuttavia, gli IC erano ampi (vedere la Figura 4B e la Tabella supplementare S4 in “Dati supplementari” nel numero online). Quando lo Shanghai Women’s Health Study (che sembrava rappresentare un’anomalia) è stato escluso, il test di non linearità non era più altrettanto significativo (non linearità di P = 0.62) e la correlazione risultava essere nulla per l’intero intervallo di assunzione (risultati non mostrati).
Figura 4. A-D: Consumo di latte (e sua tipologia) e rischio di diabete di tipo 2. Il RR complessivo utilizzando modelli ad effetti random per 200 g/die era 0.87 (IC 95%: 0.72, 1.04; I2 = 93.6%; eterogeneità di P < 0.0001; n = 167.982) (A). C’era la prova di un’associazione inversa non lineare tra il consumo di latte e il diabete di tipo 2 ( non linearità di P < 0.0001) (B), e prove di una correlazione positiva non lineare tra il consumo di latte intero e il diabete di tipo 2 (non linearità di P = 0.01) (C), mentre la correlazione tra latte magro o scremato e il diabete di tipo 2 sembrava essere lineare (non linearità di P = 0.44)) (D).
Formaggio
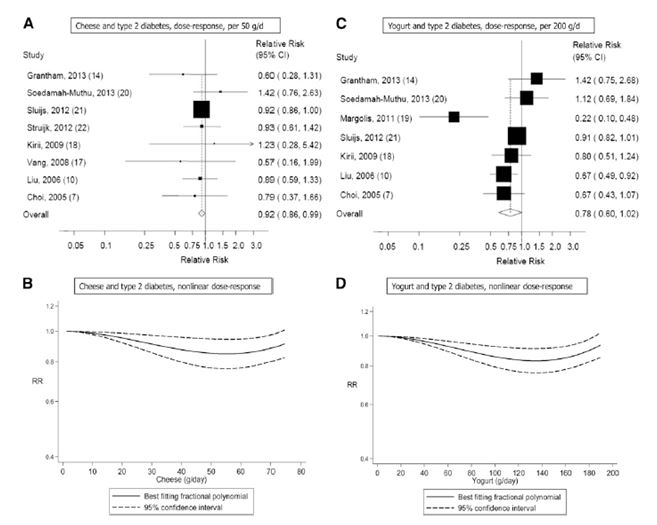
Otto studi di coorte (7, 10, 14, 17, 18, 20-22) sono stati inclusi nell’analisi relativa al consumo di formaggio e al rischio di diabete di tipo 2 e comprendevano un totale di 17.620 casi tra i 242.960 partecipanti. Il RR complessivo per il consumo più alto rispetto a quello più basso era di 0.91 (IC 95%: 0.84, 0.98), senza eterogeneità (I2 = 0%; eterogeneità P = 0.57) (vedere la Figura S5 supplementare presente in “Dati supplementari” nel numero online). Il RR complessivo per 50 g/die di formaggio era 0.92 (IC 95%: 0.86, 0.99), con assenza di eterogeneità (I2 = 0%, eterogeneità P = 0.79) (Figura 5A). I RR complessivi erano compresi tra 0.91 (IC 95%: 0.72, 1.14) quando è stato escluso lo studio EPIC-Interact (21) e 0.93 (IC 95%: 0.86, 0.99) quando è stato escluso l’Australian Diabetes Obesity and Lifestyle Study (14). Non ci sono prove della presenza di bias di pubblicazione con il test di Egger (P = 0.74). C’era qualche prova della presenza di una correlazione non lineare tra il consumo di formaggio e il diabete di tipo 2 (non linearità P = 0.05), con una diminuzione del rischio per un consumo fino a ~ 50 g/die (vedere la Figura 5B e la Tabella Supplementare S5 in “Dati supplementari” nel numero online); tuttavia, esistevano pochi relativi a quel valore.
Yogurt
Sette studi di coorte (7, 10, 14, 18-21) sono stati inclusi nell’analisi relativa ad un consumo più alto rispetto ad uno più basso di yogurt e al rischio di diabete di tipo 2, e comprendevano un totale di 19.082 casi tra i 254.892 partecipanti. Il RR complessivo era 0.86 (IC 95%: 0.75, 0.98), con moderata eterogeneità (I2 = 58.9%, eterogeneità P = 0.02) (vedere la Figura S6 supplementare in “Dati supplementari” nel numero online). Il RR complessivo per 200 g/die era 0.78 (IC 95%: 0.60, 1.02), con elevata eterogeneità (I2 = 69.9%; eterogeneità P = 0.003) (Figura 5C). I RR complessivi erano compresi tra 0.73 (IC 95%: 0.55, 0.96) quando è stato escluso l’Australian Diabetes Obesity and Lifestyle Study (14), e 0.86 (IC 95%: 0.72, 1.02) quando è stato escluso il Women’s Health Initiative Observational Study (19). La maggior parte dell’eterogeneità poteva essere attribuita a quest’ultimo studio e quando escluso si è ottenuto (I2 = 34.3%; eterogeneità P = 0.18). Non ci sono prove della presenza di bias di pubblicazione con il test di Egger (P = 0,37). C’erano però le prove dell’esistenza di una correlazione non lineare tra il consumo di yogurt e il diabete di tipo 2 (non linearità P = 0,004), e non vi era un’ulteriore diminuzione del rischio con un consumo > 120-140 g/die (vedere la Figura 5D e la Tabella Supplementare S6 in “Dati supplementari” nel numero online).
Figura 5. A-D: Consumo di formaggio e yogurt e rischio di diabete di tipo 2. I RR complessivi utilizzando modelli ad effetti random erano 0.92 (IC 95%: 0.86, 0.99; I2 = 0%; eterogeneità di P = 0.79; n =242.960) per 50 g di formaggio/die (A, B) e 0.78 (IC 95%: 0.60, 1.02; I2 = 69.9 %; eterogeneità di P = 0.003; n = 254.892) per 200g/die di yogurt (C-D).
Altri prodotti lattiero-caseari
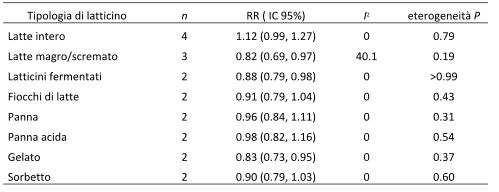
Pochi studi riportavano risultati relativi ad altri specifici prodotti lattiero-caseari. Correlazioni inverse sono state osservate per quanto riguarda consumi elevati vs consumi più bassi di latte magro o scremato (RR complessivo = 0.82, IC 95%: 0.69, 0.97, I2 = 40.1%, eterogeneità P = 0.19) (7, 10, 14), di latticini fermentati (RR complessivo = 0.88; IC 95%: 0.79, 0.98; I2 = 0%; eterogeneità P > 0.99) (21,22) e di gelato (RR complessivo = 0.83; IC 95%: 0.73, 0.95; I2 = 0%; eterogeneità P = 0.37) (7, 10), ma non vi era alcuna correlazione significativa relativa al consumo di latte intero ( RR complessivo = 1.12, IC 95%: 0.99, 1.27; I2 = 0%; eterogeneità P = 0.79) (7, 8, 10, 14), di ricotta (RR complessivo = 0.91; IC 95%: 0.79, 1.04; I2 = 0%; eterogeneità P = 0.43) (7, 10), di panna (RR complessivo = 0.96; IC 95%: 0.84, 1.11; I2 = 4.9%; eterogeneità P = 0.31) (7, 10), di panna acida (RR complessivo = 0.98; IC 95%: 0.82, 1.16; I2 = 0%; eterogeneità P = 0.54) (7, 10) o di sorbetto (RR complessivo = 0.90; IC 95%: 0.79, 1.03; I2 = 0%; eterogeneità P = 0.60) (7, 10) (Tabella 2). I RR complessivi erano 1.06 (IC 95%: 0.93, 1.20, I2 = 22.5%, eterogeneità P = 0.28) per 200 g di latte intero/die (vedere la Figura integrativa S7 in “Dati supplementari” nel numero online) e 0.89 ( IC 95%: 0.84, 0.95; I2 = 0%; eterogeneità P = 0.57) per 200 g/die di latte magro o scremato (vedere la figura supplementare S8 nella sezione “Dati supplementari” nel numero online). Visti i pochi studi non siamo riusciti a condurre un’analisi dose-risposta sui rimanenti sottotipi di latticini. Si ipotizza l’esistenza di una correlazione non lineare tra il consumo di latte intero e il diabete di tipo 2 (non linearità P = 0.01), con un rapido aumento del rischio quando si aumentano i consumi partendo da basse quantità fino a 40-50 g/die (vedi Figura 4C e Tabella Supplementare S7 in “Dati supplementari” nel numero online), mentre la correlazione tra il latte magro o scremato e il diabete di tipo 2 sembrava essere di tipo lineare (non linearità P = 0.44) (vedi Figura 4D e Tabella Supplementare S8 in “Dati supplementari” nel numero online).
Tabella 2. Altri sottotipi di latticini e rischio di diabete di tipo 2: consumi elevati messi a confronto con consumi inferiori.
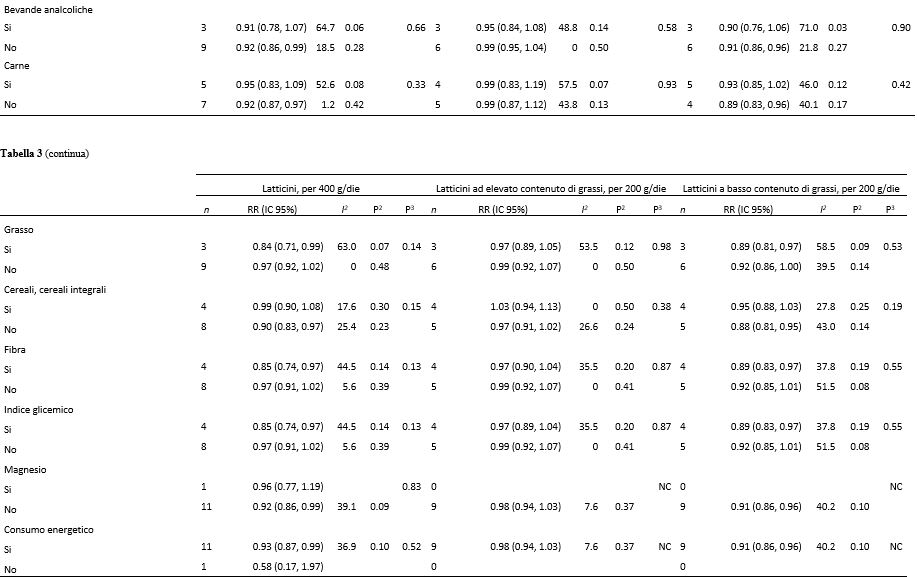
Analisi di sottogruppo, di sensibilità e di meta-regressione
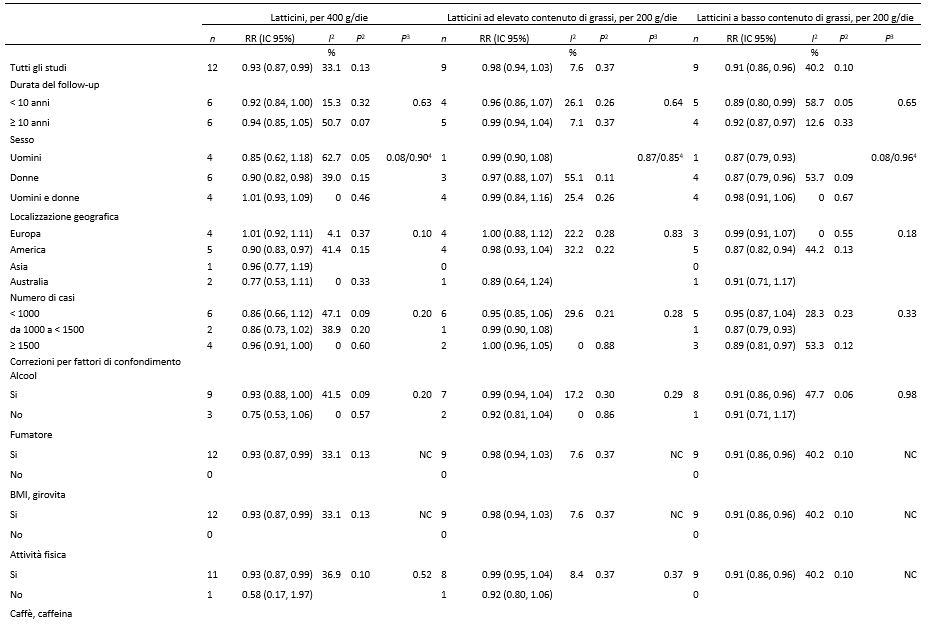
Nelle analisi di sottogruppo e di meta-regressione, non abbiamo riscontrato alcuna eterogeneità significativa tra sottogruppi quando gli studi sono stati stratificati per sesso, durata del follow-up, posizione geografica o dimensione dello studio (Tabelle 3 e 4). C’erano alcune indicazioni su come la correlazione inversa tra i latticini totali e lo yogurt e il diabete di tipo 2 fosse limitata agli studi americani ma non a quelli europei; tuttavia, i test di eterogeneità non erano significativi (P = 0.10 e 0.75, rispettivamente). Ulteriori analisi dei sottogruppi, indipendentemente dal fatto che gli studi fossero stati corretti per eventuali fattori di confondi mento, non hanno mostrato una significativa eterogeneità tra gli strati, nonostante le associazioni non fossero sempre significative. Nelle analisi di sensibilità, abbiamo nuovamente analizzato i latticini totali, i latticini ad elevato contenuto di grassi e i latticini a basso contenuto di grassi dei 6 studi comuni alle 3 tipologie di analisi (7, 10, 13, 15, 20, 22) e i RR complessivi erano 0.90 per i latticini totali (IC 95%: 0.80, 1.01; I2 = 49.7%; eterogeneità P = 0.08), 0.99 (IC 95%: 0.93, 1.05; I2 = 30.9%; eterogeneità P = 0.20) per i latticini ad elevato contenuto di grassi e 0.91 (IC 95%: 0.86, 0.96, I2 = 24.2%, eterogeneità P = 0.25) per i latticini a basso contenuto di grassi, che risultavano essere simili a quelli dell’analisi complessiva.
Tabella 3. Analisi di sottogruppo relative al consumo di latticini totali, di latticini ad elevato e a basso contenuto di grassi e rischio di diabete di tipo 2: analisi dose-risposta1
1n, numero di studi; NC, non calcolabile.
2P value per l’eterogeneità all’interno di ogni sottogruppo.
3P value per l’eterogeneità tra i sottogruppi con analisi di meta regressione.
4P value per l’eterogeneità tra uomini e donne (studi con entrambi i sessi sono stati esclusi).
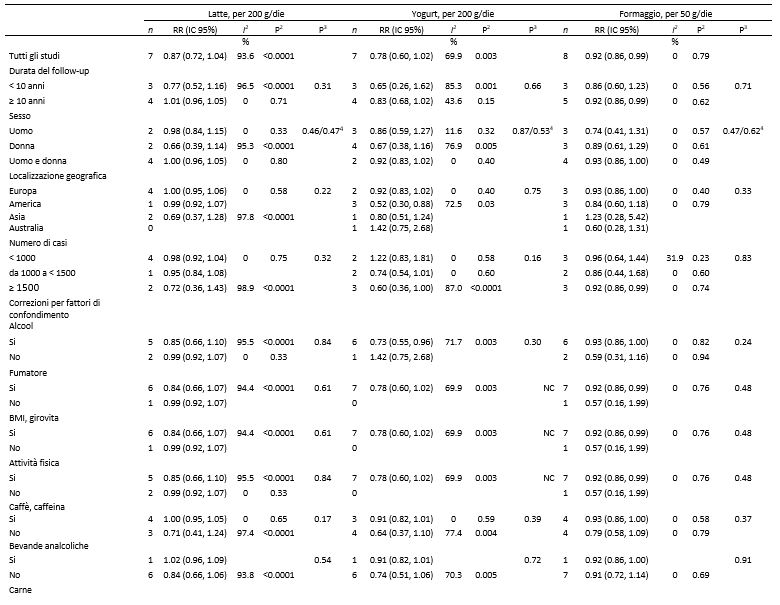
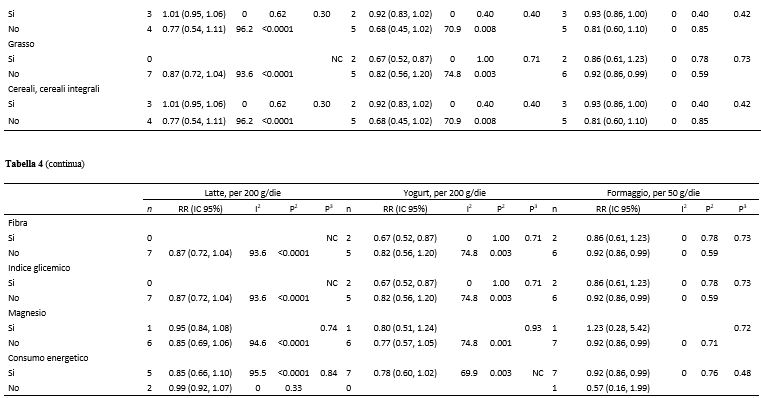
Tabella 4. Analisi di sottogruppo relative al consumo di latte, yogurt, formaggio e rischio di diabete di tipo 2: analisi dose-risposta1
1n, numero di studi; NC, non calcolabile.
2P value per l’eterogeneità all’interno di ogni sottogruppo.
3P value per l’eterogeneità tra i sottogruppi con analisi di meta regressione.
4P value per l’eterogeneità tra uomini e donne (studi con entrambi i sessi sono stati esclusi).
Discussione
In questa meta-analisi, un consumo elevato di latticini è stato associato ad una significativa diminuzione del rischio di diabete di tipo 2. Associazioni inverse significative sono state riscontrate anche per quanto riguarda i latticini a basso contenuto di grassi, il latte magro o scremato, il formaggio e lo yogurt (in relazione all’analisi dei consumi più elevati confrontati con quelli più bassi), ma non è stata individuata una correlazione significativa con i latticini ad elevato contenuto di grassi o con il latte totale. I risultati ottenuti da questa meta-analisi supportano l’ipotesi che il consumo di latticini diminuisca il rischio di diabete di tipo 2 e concordano con i risultati provenienti da due precedenti meta-analisi di studi di coorte su latticini e diabete di tipo 2, che evidenziavano l’esistenza di correlazioni inverse (26, 28). Inoltre, abbiamo anche quantificato questa correlazione tra il consumo di latticini e il rischio di diabete di tipo 2, conducendo analisi dose-risposta lineari e non lineari e analizzando specifiche tipologie di latticini. Le analisi dose-risposta sono importanti per poter fornire eventuali raccomandazioni sul consumo in relazione ad una diminuzione del rischio. Inoltre, è importante stabilire i potenziali effetti soglia per la valutazione dei benefici e dei rischi, visto che esistono alcune prove degli effetti negativi del consumo di latticini su determinate malattie (40, 41). Poiché questa era una meta-analisi di studi osservazionali, alcune limitazioni potrebbero aver influenzato i risultati. È possibile che l’associazione inversa osservata tra il consumo di latticini e il rischio di diabete di tipo 2 possa essere il risultato di un confondimento non misurato o residuo. Un aumento del consumo di latticini, in particolare di quelli a basso contenuto di grassi, potrebbe essere associato alla presenza di altri comportamenti considerati salutari, come l’aumento dell’attività fisica svolta, un maggior consumo di cereali integrali e fibre, un minor consumo di sigarette e una diminuzione di sovrappeso/obesità, ma anche ad una diminuzione dei consumi di carne rossa e di carne lavorata. Tuttavia, molti degli studi inclusi in questa meta-analisi sono stati corretti per fattori di confondimento noti come l’età, l’indice di massa corporea (BMI), il fumo e il consumo di fibre e di energia. Nelle analisi di sottogruppo quando si stratificava in base ai latticini, ai latticini a basso contenuto di grassi e al formaggio, le correlazioni persistevano in diverse, sebbene non in tutte, analisi di sottogruppo indipendentemente dalla correzione fatta per gli eventuali fattori di confondimento, probabilmente a causa della scarsità di studi per alcuni sottogruppi. Tuttavia, non abbiamo riscontrato prove dell’esistenza di eterogeneità tra questi sottogruppi mediante l’analisi di meta-regressione. Inoltre, è possibile che i bias di pubblicazione abbiano influenzato i risultati; tuttavia, con i test statistici non abbiamo riscontrato alcuna prova di bias di pubblicazione e non sono state evidenziate asimmetrie nei funnel plots quando valutati visivamente. Poiché vi erano pochi studi che si occupavano degli specifici prodotti lattiero-caseari elencati in Tabella 2, ne sono necessari altri per chiarire tali risultati. Errori di misurazione nella valutazione del regime dietetico alimentare pregiudicano le stime dell’effetto. La maggior parte degli studi inclusi nella nostra meta-analisi utilizzava questionari di frequenza alimentare convalidati, ma solo uno studio è stato corretto per errori di misurazione (21). I risultati sono apparsi solo leggermente più convincenti dopo correzione per l’errore di misurazione, con HR pari a 1.03 (IC 95%: 0.87, 1.22) e a 0.84 (IC 95%: 0.73, 0.97) per i latticini totali e il formaggio, rispettivamente, rispetto ad HR pari a 1.01 (IC 5%: 0.89, 1.13) e 0.88 (IC 95%: 0.76, 1.02) ottenuti senza correzione per l’errore di misurazione. In questa meta-analisi la messa in evidenza di una correlazione inversa tra il consumo di latticini e il diabete di tipo 2 è coerente con i risultati di precedenti ricerche che evidenziavano una diminuzione del rischio o della prevalenza della sindrome metabolica (16, 23, 42-46) e dell’insulino-resistenza (47- 49) in diversi studi epidemiologici, sebbene in alcuni non sia stata evidenziata alcuna associazione (50, 51). Differenti meccanismi potrebbero spiegare l’esistenza di una correlazione inversa tra i latticini e il diabete di tipo 2. I latticini sono un’importante fonte di calcio, vitamina D, proteine e magnesio. In esperimenti condotti sugli animali e in studi fatti sull’uomo, è stato dimostrato come il calcio aumenti la secrezione di insulina e sia essenziale per i tessuti insulino-dipendenti (come il muscolo scheletrico e il tessuto adiposo) e come sia in grado di ridurre l’insulino-resistenza (27). Inoltre, alcune tipologie di latticini possono essere arricchite con vitamina D, che viene spesso associata ad una diminuzione del rischio di diabete (52), probabilmente perché in grado di influenzare la secrezione di insulina e di ridurre l’insulino-resistenza (27). Tuttavia, lo studio randomizzato Women’s Health Initiative non ha riscontrato alcuna correlazione tra l’integrazione con calcio e vitamina D e l’incidenza del diabete di tipo 2 (53). I latticini contengono proteine (presenti nel siero del latte) che sembrano essere in grado di ridurre l’aumento del peso corporeo e di aumentare la sensibilità all’insulina nei modelli animali (54). Inoltre, i latticini sono una fonte importante di magnesio che, negli studi epidemiologici, è stato associato ad una diminuzione del rischio di diabete (55) e in alcuni studi sperimentali ad un miglioramento della sensibilità all’insulina, sebbene i dati siano limitati (56). Anche il tenore di grassi dei latticini potrebbe influenzare il rischio di diabete. Non abbiamo riscontrato alcuna correlazione tra i latticini ad elevato contenuto di grassi e il rischio di diabete di tipo 2, ma nelle analisi non lineari ci sono alcune prove di un aumento del rischio dovuto al consumo di latte intero, che contrasta con la correlazione inversa associata al consumo di latticini a basso contenuto di grassi e di latte magro o scremato. Questo ci suggerisce come il contenuto in grassi di alcuni latticini potrebbe inficiare l’effetto benefico degli altri nutrienti presenti nei prodotti lattiero-caseari. Tuttavia, i risultati non concordano con quelli ottenuti da 2 studi recenti che mettevano in evidenza l’esistenza di correlazioni inverse tra le concentrazioni plasmatiche di acido trans-palmitoleico, un biomarker del grasso del latte, e il rischio di diabete di tipo 2 (29, 57). Non è chiaro se queste differenze siano il risultato di errori di misurazione del consumo di latticini ad elevato contenuto di grassi o se l’effetto benefico dell’acido trans–palmitoleico sia associato all’assunzione di specifici prodotti caseari come formaggio e yogurt, che troviamo inversamente correlati al diabete e che comunque possono essere ricchi di grassi. La nostra meta-analisi ha anche diversi punti di forza. Siccome abbiamo basato le nostre analisi su studi prospettici, abbiamo effettivamente evitato il recall bias e ridotto la possibilità di bias di selezione. Abbiamo condotto analisi dose-risposta per indagare se specifiche quantità di latticini consumati fossero associate al rischio di diabete di tipo 2. L’interpretazione dei nostri risultati, per quanto concerne le eventuali raccomandazioni sulla salute pubblica, è tuttavia complicata dal fatto che il consumo di latte e latticini (e di altri prodotti caseari) potrebbe avere sia effetti positivi (36, 58) che negativi (40, 41) per quanto concerne altre malattie. Sono necessari ulteriori studi sui latticini e sugli esiti riguardanti la salute in generale e la mortalità, per garantire una valutazione più dettagliata dei costi-benefici relativi al consumo di latticini. In conclusione, i risultati da noi ottenuti suggeriscono come il consumo di latticini, di latticini a basso contenuto di grassi e di formaggio sia inversamente correlato al rischio di sviluppare il diabete di tipo 2. Eventuali studi futuri dovrebbero valutare l’esistenza di una correlazione tra altre tipologie specifiche di prodotti lattiero-caseari e il rischio di diabete di tipo 2, correggendo anche per altri fattori di confondimento.
Ringraziamo Peter C Elwood e Janet Pickering per averci fornito le informazioni aggiuntive provenienti dal Caerphilly cohort study e Dianna Magliano e Stephanie Tanamas per averci fornito informazioni supplementari provenienti dall’Australian Diabetes Obesity and Lifestyle Study.
I compiti degli autori erano i seguenti – DA: progettazione dello studio, conduzione della ricerca in letteratura e delle analisi e scrittura della prima bozza del manoscritto; – DA, TN, PR e LJV: interpretazione dei dati, revisione delle bozze successive e approvazione della versione finale del manoscritto da pubblicare. Gli autori hanno dichiarato che non vi era conflitto d’interessi relativo a questo articolo.
Riferimenti
- Whiting DR, Guariguata L, Weil C, Shaw J. IDF diabetes atlas: global estimates of the prevalence of diabetes for 2011 and 2030. Diabetes Res Clin Pract 2011;94:311–21.
- Aune D, Ursin G, Veierod MB. Meat consumption and the risk of type 2 diabetes: a systematic review and meta-analysis of cohort studies. Diabetologia 2009;52:2277–87.
- Pan A, Sun Q, Bernstein AM, Schulze MB, Manson JE, Willett WC, Hu FB. Red meat consumption and risk of type 2 diabetes: 3 cohorts of US adults and an updated meta-analysis. Am J Clin Nutr 2011;94: 1088–96.
- de Munter JS, Hu FB, Spiegelman D, Franz M, van Dam RM. Whole grain, bran, and germ intake and risk of type 2 diabetes: a prospective cohort study and systematic review. PLoS Med 2007;4:e261.
- Schulze MB, Schulz M, Heidemann C, Schienkiewitz A, Hoffmann K, Boeing H. Fiber and magnesium intake and incidence of type 2 diabetes: a prospective study and meta-analysis. Arch Intern Med 2007; 167:956–65.
- Rice BH, Cifelli CJ, Pikosky MA, Miller GD. Dairy components and risk factors for cardiometabolic syndrome: recent evidence and opportunities for future research. Adv Nutr 2011;2:396–407.
- Choi HK, Willett WC, Stampfer MJ, Rimm E, Hu FB. Dairy consumption and risk of type 2 diabetes mellitus in men: a prospective study. Arch Intern Med 2005;165:997–1003.
- Montonen J, Jarvinen R, Heliovaara M, Reunanen A, Aromaa A, Knekt P. Food consumption and the incidence of type II diabetes mellitus. Eur J Clin Nutr 2005;59:441–8.
- Pittas AG, Dawson-Hughes B, Li T, van Dam RM, Willett WC, Manson JE, Hu FB. Vitamin D and calcium intake in relation to type 2 diabetes in women. Diabetes Care 2006;29:650–6.
- Liu S, Choi HK, Ford E, Song Y, Klevak A, Buring JE, Manson JE. A prospective study of dairy intake and the risk of type 2 diabetes in women. Diabetes Care 2006;29:1579–84.
- Lecomte P, Vol S, Caces E, Born C, Chabrolle C, Lasfargues G, Halimi G, Tichet J. Five-year predictive factors of type 2 diabetes in men with impaired fasting glucose. Diabetes Metab 2007;33:140–7.
- Villegas R, Gao YT, Dai Q, Yang G, Cai H, Li H, Zheng W, Shu XO. Dietary calcium and magnesium intakes and the risk of type 2 diabetes: the Shanghai Women’s Health Study. Am J Clin Nutr 2009;89:1059–67.
- Malik VS, Sun Q, van Dam RM, Rimm EB, Willett WC, Rosner B, Hu FB. Adolescent dairy product consumption and risk of type 2 diabetes in middle-aged women. Am J Clin Nutr 2011;94:854–61.
- Grantham NM, Magliano DJ, Hodge A, Jowett J, Meikle P, Shaw JE. The association between dairy food intake and the incidence of diabetes in Australia: the Australian Diabetes Obesity and Lifestyle Study (AusDiab). Public Health Nutr 2013;16:339–45.
- van Dam RM, Hu FB, Rosenberg L, Krishnan S, Palmer JR. Dietary calcium and magnesium, major food sources, and risk of type 2 diabetes in U.S. black women. Diabetes Care 2006;29:2238–43.
- Elwood PC, Pickering JE, Fehily AM. Milk and dairy consumption, diabetes and the metabolic syndrome: the Caerphilly prospective study. J Epidemiol Community Health 2007;61:695–8.
- Vang A, Singh PN, Lee JW, Haddad EH, Brinegar CH. Meats, processed meats, obesity, weight gain and occurrence of diabetes among adults: findings from Adventist Health Studies. Ann Nutr Metab 2008; 52:96–104.
- Kirii K, Mizoue T, Iso H, Takahashi Y, Kato M, Inoue M, Noda M, Tsugane S; Japan Public Health Center-based Prospective Study Group. Calcium, vitamin D and dairy intake in relation to type 2 diabetes risk in a Japanese cohort. Diabetologia 2009;52:2542–50.
- Margolis KL, Wei F, de Boer IH, Howard BV, Liu S, Manson JE, Mossavar-Rahmani Y, Shikany JM, Tinker LF; Women’s Health Initiative Investigators. A diet high in low-fat dairy products lowers diabetes risk in postmenopausal women. J Nutr 2011;141:1969–74.
- Soedamah-Muthu SS, Masset G, Verberne L, Geleijnse JM, Brunner EJ. Consumption of dairy products and associations with incident diabetes, CHD and mortality in the Whitehall II study. Br J Nutr 2013; 109:718–26.
- Sluijs I, Forouhi NG, Beulens JW, van der Schouw YT, Agnoli C, Arriola L, Balkau B, Barricarte A, Boeing H, Bueno-de-Mesquita HB, et al. The amount and type of dairy product intake and incident type 2 diabetes: results from the EPIC-InterAct Study. Am J Clin Nutr 2012;96:382–90.
- Struijk EA, Heraclides A, Witte DR, Soedamah-Muthu SS, Geleijnse JM, Toft U, Lau CJ. Dairy product intake in relation to glucose regulation indices and risk of type 2 diabetes. Nutr Metab Cardiovasc Dis (Epub ahead of print 2012).
- Louie JC, Flood VM, Rangan AM, Burlutsky G, Gill TP, Gopinath B, Mitchell P. Higher regular fat dairy consumption is associated with lower incidence of metabolic syndrome but not type 2 diabetes. Nutr Metab Cardiovasc Dis (Epub ahead of print 2012).
- von Ruesten A, Feller S, Bergmann MM, Boeing H. Diet and risk of chronic diseases: results from the first 8 years of follow-up in the EPICPotsdam study. Eur J Clin Nutr 2013;67:412–9.
- Elwood PC, Givens DI, Beswick AD, Fehily AM, Pickering JE, Gallacher J. The survival advantage of milk and dairy consumption: an overview of evidence from cohort studies of vascular diseases, diabetes and cancer. J Am Coll Nutr 2008;27:723S–34S.
- Elwood PC, Pickering JE, Givens DI, Gallacher JE. The consumption of milk and dairy foods and the incidence of vascular disease and diabetes: an overview of the evidence. Lipids 2010;45:925–39.
- Pittas AG, Lau J, Hu FB, Dawson-Hughes B. The role of vitamin D and calcium in type 2 diabetes: a systematic review and meta-analysis. J Clin Endocrinol Metab 2007;92:2017–29.
- Tong X, Dong JY, Wu ZW, Li W, Qin LQ. Dairy consumption and risk of type 2 diabetes mellitus: a meta-analysis of cohort studies. Eur J Clin Nutr 2011;65:1027–31.
- Mozaffarian D, de Oliveira Otto MC, Lemaitre RN, Fretts AM, Hotamisligil G, Tsai MY, Siscovick DS, Nettleton JA. trans-Palmitoleic acid, other dairy fat biomarkers, and incident diabetes: the Multi-Ethnic Study of Atherosclerosis (MESA). Am J Clin Nutr 2013;97:854–61.
- Feskens EJ, Virtanen SM, Rasanen L, Tuomilehto J, Stengard J, Pekkanen J, Nissinen A, Kromhout D. Dietary factors determining diabetes and impaired glucose tolerance: a 20-year follow-up of the Finnish and Dutch cohorts of the Seven Countries Study. Diabetes Care 1995;18:1104–12.
- Agrawal S, Ebrahim S. Prevalence and risk factors for self-reported diabetes among adult men and women in India: findings from a National cross-sectional survey. Public Health Nutr 2012;15:1065–77.
- Fumeron F, Lamri A, Emery N, Bellili N, Jaziri R, Porchay-Balderelli I, Lantieri O, Balkau B, Marre M; DESIR Study Group. Dairy products and the metabolic syndrome in a prospective study, DESIR. J Am Coll Nutr 2011;30(suppl 1):454S–63S.
- DerSimonian R, Laird N. Meta-analysis in clinical trials. Control Clin Trials 1986;7:177–88.
- Greenland S, Longnecker MP. Methods for trend estimation from summarized dose-response data, with applications to meta-analysis. Am J Epidemiol 1992;135:1301–9.
- Aune D, Greenwood DC, Chan DS, Vieira R, Vieira AR, Navarro Rosenblatt DA, Cade JE, Burley VJ, Norat T. Body mass index, abdominal fatness and pancreatic cancer risk: a systematic review and non-linear dose-response meta-analysis of prospective studies. Ann Oncol 2012;23:843–52.
- Aune D, Lau R, Chan DS, Vieira R, Greenwood DC, Kampman E, Norat T. Dairy products and colorectal cancer risk: a systematic review and meta-analysis of cohort studies. Ann Oncol 2012;23:37–45.
- Royston P. A strategy for modelling the effect of a continuous covariate in medicine and epidemiology. Stat Med 2000;19:1831–47.
- Higgins JP, Thompson SG. Quantifying heterogeneity in a meta-analysis. Stat Med 2002;21:1539–58.
- Egger M, Davey SG, Schneider M, Minder C. Bias in meta-analysis detected by a simple, graphical test. BMJ 1997;315:629–34.
- Chen H, O’Reilly E, McCullough ML, Rodriguez C, Schwarzschild MA, Calle EE, Thun MJ, Ascherio A. Consumption of dairy products and risk of Parkinson’s disease. Am J Epidemiol 2007;165:998–1006.
- Gao X, LaValley MP, Tucker KL. Prospective studies of dairy product and calcium intakes and prostate cancer risk: a meta-analysis. J Natl Cancer Inst 2005;97:1768–77.
- Lutsey PL, Steffen LM, Stevens J. Dietary intake and the development of the metabolic syndrome: the Atherosclerosis Risk in Communities Study. Circulation 2008;117:754–61.
- Fumeron F, Lamri A, Abi Khalil C, Jaziri R, Porchay-Balderelli I, Lantieri O, Vol S, Balkau B, Marre M; Data from the Epidemiological Study on the Insulin Resistance Syndrom (DESIR) Study Group. Dairy consumption and the incidence of hyperglycemia and the metabolic syndrome: results from a French prospective study, Data from the Epidemiological Study on the Insulin Resistance Syndrome (DESIR). Diabetes Care 2011;34:813–7.
- Azadbakht L, Mirmiran P, Esmaillzadeh A, Azizi F. Dairy consumption is inversely associated with the prevalence of the metabolic syndrome in Tehranian adults. Am J Clin Nutr 2005;82:523–30.
- Liu S, Song Y, Ford ES, Manson JE, Buring JE, Ridker PM. Dietary calcium, vitamin D, and the prevalence of metabolic syndrome in middle-aged and older U.S. women. Diabetes Care 2005;28:2926–32.
- Kim J. Dairy food consumption is inversely associated with the risk of the metabolic syndrome in Korean adults. J Hum Nutr Diet 2013; 26(suppl 1):171–9.
- Pereira MA, Jacobs DR Jr, Van HL, Slattery ML, Kartashov AI, Ludwig DS. Dairy consumption, obesity, and the insulin resistance syndrome in young adults: the CARDIA Study. JAMA 2002;287:2081–9.
- Rideout TC, Marinangeli CP, Martin H, Browne RW, Rempel CB. Consumption of low-fat dairy foods for 6 months improves insulin resistance without adversely affecting lipids or bodyweight in healthy adults: a randomized free-living cross-over study. Nutr J 2013;12:56.
- Akter S, Kurotani K, Nanri A, Pham NM, Sato M, Hayabuchi H, Mizoue T. Dairy consumption is associated with decreased insulin resistance among the Japanese. Nutr Res 2013;33:286–92.
- te Velde SJ, Snijder MB, van Dijk AE, Brug J, Koppes LL, van Mechelen W, Twisk JW. Dairy intake from adolescence into adulthood is not associated with being overweight and metabolic syndrome in adulthood: the Amsterdam Growth and Health Longitudinal Study. J Hum Nutr Diet 2011;24:233–44.
- Snijder MB, van der Heijden AA, van Dam RM, Stehouwer CD, Hiddink GJ, Nijpels G, Heine RJ, Bouter LM, Dekker JM. Is higher dairy consumption associated with lower body weight and fewer metabolic disturbances? The Hoorn Study. Am J Clin Nutr 2007;85: 989–95.
- Mitri J, Muraru MD, Pittas AG. Vitamin D and type 2 diabetes: a systematic review. Eur J Clin Nutr 2011;65:1005–15.
- de Boer I, Tinker LF, Connelly S, Curb JD, Howard BV, Kestenbaum B, Larson JC, Manson JE, Margolis KL, Siscovick DS, et al. Calcium plus vitamin D supplementation and the risk of incident diabetes in the Women’s Health Initiative. Diabetes Care 2008;31:701–7.
- Belobrajdic DP, McIntosh GH, Owens JA. A high-whey-protein diet reduces body weight gain and alters insulin sensitivity relative to red meat in Wistar rats. J Nutr 2004;134:1454–8.
- Dong JY, Xun P, He K, Qin LQ. Magnesium intake and risk of type 2 diabetes: meta-analysis of prospective cohort studies. Diabetes Care 2011;34:2116–22.
- Volpe SL. Magnesium, the metabolic syndrome, insulin resistance, and type 2 diabetes mellitus. Crit Rev Food Sci Nutr 2008;48:293– 300.
- Mozaffarian D, Cao H, King IB, Lemaitre RN, Song X, Siscovick DS, Hotamisligil GS. Trans-palmitoleic acid, metabolic risk factors, and new-onset diabetes in U.S. adults: a cohort study. Ann Intern Med 2010;153:790–9.
- Dong JY, Zhang L, He K, Qin LQ. Dairy consumption and risk of breast cancer: a meta-analysis of prospective cohort studies. Breast Cancer Res Treat 2011;127:23–31.
Il Materiale Supplementare può essere trovato su:
ajcn.nutrition.org/content/suppl/2013/09/16/ajcn.113.059030.DCSupplemental.html
Am J Clin Nutr 2013;98:1066–83. Printed in USA. © 2013 American Society for Nutrition