Estrazione e valutazione della qualità dei dati
Analisi statistiche e sintesi dei dati
Abstract
Alcuni studi hanno riportato che il consumo di latte e latticini riduce l’incidenza del cancro alla vescica, mentre altri riportavano risultati inconcludenti o diametralmente opposti. Questa meta-analisi di 26 studi è stata condotta per mettere in evidenza l’eventuale esistenza di una correlazione tra il consumo di latte e latticini e il rischio di sviluppare un cancro alla vescica. È stata condotta una ricerca sistematica su MEDLINE, EMBASE e Web of Science (dalla loro creazione fino al 30 aprile 2018). Sono stati utilizzati modelli ad effetto random per calcolare le stime pooled per i RR di un consumo elevato o medio versus un consumo più basso di latte e latticini. Sono state condotte analisi di sensibilità. Sono state effettuate analisi di sottogruppo in base alla tipologia di latticino, al genere, alla posizione geografica e alla tipologia di studio. La meta-regressione degli effetti random è stata utilizzata per valutare altri fattori confondenti. Nel complesso il consumo medio, rispetto al consumo basso, è stato associato ad una diminuzione del rischio di cancro alla vescica per i prodotti lattiero-caseari totali (RR = 0.90; IC 95%: 0.81, 0.98), il latte (RR = 0.90; IC 95% : 0.82, 0.98) ed i latticini fermentati (RR = 0.87; IC 95%: 0.79, 0.96). La correlazione inversa relativa al consumo di latte era maggiore negli asiatici (RR = 0.79; IC 95%: 0.59, 0.98) e negli studi di coorte (RR = 0,85; 95% CI: 0.71, 0.99). Inoltre un consumo elevato, se paragonato ad uno più basso, è stato significativamente associato ad un più basso rischio per il latte (RR = 0.89; IC 95%: 0.81, 0.98) e per i latticini fermentati (RR = 0.78; IC 95%: 0.61, 0.94). Tuttavia un elevato consumo di latte intero, rispetto ad un consumo più basso, è stato significativamente associato ad un aumento del rischio (RR = 1.21; IC 95%: 1.04, 1.38). L’eterogeneità statistica era considerevole. In conclusione, la presente meta-analisi suggerisce una diminuzione del rischio di cancro alla vescica correlata ad un consumo medio di latticini totali e ad un consumo medio ed elevato di latte e di latticini fermentati. Un aumento del rischio di cancro alla vescica è stato osservato con un elevato consumo di latte intero. L’interpretazione dei risultati deve essere fatta con cautela. Questa review è stata registrata su www.crd.york.ac.uk/prospero come CRD42018097020. Adv Nutr 2019;10:S224–S238.
Parole chiave: latte, latticini, latticini fermentati, latte intero, cancro alla vescica, meta-analisi, review sistematica
Introduzione
Secondo l’International Agency for Research on Cancer, il cancro della vescica è il nono tumore più comune al mondo, con 430.000 nuovi casi diagnosticati nel 2012 (3% di tutti i nuovi casi di cancro) (1). Il cancro della vescica diventa più frequente con l’aumentare dell’età e compare maggiormente negli uomini che non nelle donne. Inoltre, un fattore di rischio più comune per lo sviluppo del cancro della vescica è rappresentato dal fumo di sigaretta. I fumatori hanno 4-7 volte più probabilità di sviluppare un cancro alla vescica rispetto ai soggetti non fumatori. Altri importanti fattori di rischio sono i seguenti: l’esposizione alle ammine aromatiche e a 4,4’-metilen bis (2-cloroanilina) impiegate in differenti tipologie di industrie (tessile, stampaggio, vernici, ecc.), la schistosomiasi (una malattia parassitaria), l’esposizione all’arsenico presente nell’acqua potabile, l’utilizzo di alcuni farmaci (fenacetina, ciclofosfamide e clornafazina), le radiazioni ed i fattori genetici (2). Tuttavia, l’insorgenza del cancro alla vescica non può essere pienamente attribuita all’esposizione a questi fattori di rischio. Sebbene le prove in nostro possesso siano incoerenti o controverse, anche le abitudini alimentari potrebbero influenzare il rischio di comparsa del cancro alla vescica, dato che la maggior parte dei metaboliti viene escreta attraverso la vescica urinaria (3). Per quanto riguarda la dieta, diversi studi suggeriscono l’esistenza di un effetto protettivo dovuto al consumo di frutta e di verdura e di una possibile correlazione positiva con l’assunzione di grassi (4). L’esistenza di una correlazione tra il consumo di latte o di latticini e il rischio di cancro alla vescica è stata analizzata in diversi studi epidemiologici a partire dal 1980. Alcuni studi riportavano come un maggiore consumo di latte o di latticini diminuisse l’incidenza del cancro alla vescica, mentre altri studi non evidenziavano alcuna associazione significativa. Nel 2011, i risultati di una meta-analisi condotta da Li et al. (5) non sostenevano l’esistenza di una correlazione tra il consumo di latte (o di prodotti lattiero-caseari) ed il rischio di cancro alla vescica, ad eccezione di alcune correlazioni inverse riscontrate negli Stati Uniti, tra il rischio di cancro alla vescica e il consumo di latte e in Giappone, tra il rischio di cancro alla vescica e il consumo di prodotti lattiero-caseari. Un’altra meta-analisi condotta nel 2011 da Mao et al. (6) ha suggerito un potenziale effetto protettivo del latte nei confronti dell’insorgenza del cancro alla vescica, ma questa associazione variava ampiamente tra le regioni geografiche e tra gli specifici prodotti lattiero-caseari analizzati. Nello specifico, hanno notato un’associazione significativa tra i consumatori di elevati quantitativi di latte con una diminuzione del rischio di sviluppare un cancro della vescica solo in Asia, ed hanno ipotizzato che questa differenza di osservazioni potesse essere spiegata, almeno in parte, dalla variabilità del consumo di latte a livello mondiale (6). Tuttavia, le conclusioni ottenute da queste due meta-analisi (5, 6) apparivano coerenti per quanto riguardava i loro risultati pur essendo basate su ricerche limitate, per questo in futuro sono necessarie ulteriori ricerche per confermare questi risultati. Secondo questi risultati, il World Cancer Research Fund/American Institute for Cancer Research (WCRF/AICR), nel suo Continuous Update Project Expert Report 2018 (Dieta, nutrizione, attività fisica e cancro della vescica) (7), ha concluso che le prove per dire che un maggior consumo di latte e prodotti lattiero-caseari diminuisce il rischio di cancro alla vescica sono limitate. Visti i risultati discordanti sulla correlazione tra il consumo di latte o di latticini e il rischio di cancro alla vescica, è stata condotta questa nuova meta-analisi di studi prospettici di coorte e di studi caso-controllo (che includeva 3 ulteriori studi osservazionali pubblicati), proprio per far fronte a tale problema. L’obiettivo principale era quello di stimare il RR complessivo dell’associazione tra il consumo di latte e latticini e il cancro alla vescica, e di esaminare le potenziali fonti di eterogeneità tra gli studi. Nello specifico, sono state condotte analisi più dettagliate per chiarire la correlazione tra l’assunzione di latte o di prodotti lattiero-caseari e il rischio di cancro alla vescica, tenendo conto della tipologia di prodotti consumati, del contenuto di grassi, della quantità consumata, della posizione geografica e della tipologia di studio.
Metodi
Questo studio è stato riportato secondo le indicazioni del Meta-analysis Of Observational Studies in Epidemiology (MOOSE) (8) e seguiva le raccomandazioni del Cochrane Collaboration Handbook (9). Questa review sistematica e meta-analisi è stata protocollata nel registro internazionale prospettico delle review sistematiche (PROSPERO) come CRD42018097020.
Strategia di ricerca
Abbiamo effettuato una ricerca sistematica nelle banche dati MEDLINE (via PubMed), EMBASE e Web of Science, dalla data della loro creazione fino ad aprile 2018. Gli studi osservazionali che affrontavano l’associazione tra il consumo di prodotti caseari e il cancro alla vescica erano ritenuti idonei. I termini di ricerca utilizzati sono stati: “cancro della vescica”, “cancro-vescica”, “vescica”, “cancro alle vie urinarie”, “vescica urinaria”, “cancro”, “latticini”, “latte”, “yogurt”, “formaggio”, “kefir”, “burro”, “prodotti lattiero-caseari”, “studio di coorte”, “in base alla popolazione”, “studio caso-controllo”, “prospettico” e “caso-controllo”. La ricerca in letteratura è stata integrata con gli screening inclusi negli articoli considerati idonei per la review sistematica.
Selezione dello studio
I criteri di inclusione sono stati i seguenti: 1) partecipanti: popolazione adulta; 2) progettazione dello studio: studi di coorte o studi caso-controllo con raccolta di dati prospettivi o retrospettivi; 3) esposizione: latticini [totali, latte, (latte intero, latte magro, latte scremato), fermentati (es. yogurt, prodotti a base di latte fermentato, yakult, quark, latticello o panna acida), formaggio o burro] considerati come riportati dagli studi inclusi; e 4) esito: cancro alla vescica. I criteri per l’esclusione degli studi sono stati i seguenti: 1) report non scritti in inglese o in spagnolo; 2) studi che includevano individui con un’età inferiore ai 18 anni; e 3) tipologie di pubblicazioni non idonee come, ad esempio, articoli di review, editoriali, commenti, linee guida o case-report. Quando > 1 studio forniva dati provenienti dallo stesso campione, abbiamo considerato solo quello che riportava i risultati più dettagliati o che aveva una dimensione del campione maggiore. Tuttavia, i dati relativi alle caratteristiche del campione sono stati estratti da più report per ottenere informazioni più complete. La ricerca in letteratura è stata effettuata in maniera indipendente da 2 revisori (IC-R e LMB) e le divergenze sono state risolte o raggiungendo un accordo o coinvolgendo un terzo ricercatore (CS o BL-P).
Estrazione e valutazione della qualità dei dati
Dai report originali sono stati estratti i seguenti dati: 1) anno di pubblicazione; 2) caratteristiche dello studio (paese, periodo di raccolta dei dati e durata del follow-up), 3) caratteristiche del campione (dimensione del campione e distribuzione per età), 4) valutazione della dieta, 5) prodotto lattiero-caseario considerato, 6) numero di casi di cancro alla vescica e 7) qualità metodologica. Le informazioni relative agli studi caso-controllo e di coorte sono state estratte e organizzate separatamente in 2 tabelle. Lo strumento Quality in Prognosis Studies è stato utilizzato per valutare il rischio di bias in 6 settori: partecipazione allo studio (sampling bias), logoramento dello studio (attrition bias), misurazione del fattore prognostico, misurazione dell’esito (ascertainment bias), confondimento dello studio, analisi statistica e riferimento (10). Gli studi sono stati considerati a basso, moderato o alto rischio di bias se soddisfacevano 5-6, 3-4 o 1-2 dei 6 settori, rispettivamente. L’estrazione dei dati e la valutazione della qualità sono state effettuate in maniera indipendente da 2 ricercatori (IC-R e LMB) e le divergenze sono state risolte o raggiungendo un accordo o coinvolgendo un terzo ricercatore (CS).
Analisi statistiche e sintesi dei dati
Le categorie di consumo di latticini più basso (primo quantile riportato), medio (quantile riportato tra il primo e l’ultimo) e più alto (ultimo quantile riportato) riportate negli studi sono state considerate rispettivamente come “basso”, “medio” e “elevato” consumo di latticini. Il metodo ad effetti random di DerSimonian e Laird è stato utilizzato per calcolare le stime pooled dei RR e dei rispettivi IC al 95% per il rischio di cancro alla vescica associato al consumo di prodotti lattiero-caseari (11). I forest plots sono stati eseguiti separatamente per il consumo elevato di latticini vs. il consumo basso e per il consumo di latticini medio vs. il consumo basso. L’eterogeneità dei risultati degli studi è stata valutata utilizzando la statistica I2 (12), e i risultati sono stati valutati come: potrebbe non essere rilevante (0- 40%), potrebbe indicare un’eterogeneità moderata (30-60%), potrebbe indicare un’eterogeneità significativa (50-90%) ed è presente un’eterogeneità elevata (75-100%) (9). Inoltre, sono stati considerati i corrispondenti P value. Quando uno studio riportava numerosi modelli statistici, è stato preso in considerazione soltanto quello che comprendeva il maggior numero di covariate aggiuntive. Inoltre, quando gli studi riportavano gli OR, il RR veniva calcolato utilizzando la seguente equazione: RR = OR/(1 – Prevalenza) + (Prevalenza × OR). Le analisi di sensibilità sono state condotte escludendo gli studi uno per uno dall’effetto pooled, al fine di valutare la validità delle stime complessive e di stabilire se uno studio in particolare era responsabile di una buona percentuale dell’eterogeneità. Per stimare il rischio di cancro alla vescica correlato al consumo di prodotti lattiero-caseari, sono state condotte analisi di sottogruppo in base alla tipologia di latticino impiegato (latticini totali, latte, latte intero, latticini fermentati, formaggio e burro). Inoltre, per ogni sottogruppo di prodotto lattiero-caseario, sono state eseguite analisi di sottogruppo in base al genere, alla localizzazione geografica (Americhe, Europa e Asia) e alla tipologia di progetto dello studio (studi caso-controllo e di coorte). Le analisi dei sottogruppi sono state eseguite con ≥ 3 studi per ogni sottogruppo. Inoltre, è stata impiegata la meta-regressione degli effetti random per valutare se i risultati differissero a seconda dell’età dei partecipanti, della percentuale di fumatori attuali o dell’anno d’inizio dello studio, poiché questi aspetti potrebbero essere considerati fonti di eterogeneità. Le meta-reggressioni degli effetti random sono state eseguite solamente nei sottogruppi di latticini che includevano più di 10 studi (13). Infine, il bias di pubblicazione è stato valutato attraverso l’ispezione di funnel plots, nonché utilizzando il metodo proposto da Egger et al. (14). Le analisi statistiche sono state effettuate utilizzando il software StataSE, versione 15 (StataCorp).
Risultati
Review sistematica
Partendo dall’esame di 55 articoli full-text, 26 studi [18 studi di caso-controllo (15-32) e 8 studi di coorte (33-40)] soddisfacevano i criteri di inclusione (Figura 1). Otto studi sono stati condotti in paesi europei, 10 in paesi delle americhe e 8 in paesi asiatici. I report sono stati pubblicati tra il 1988 e il 2014. Otto studi erano di tipo prospettico e 18 di tipo retrospettivo. L’inizio della raccolta dei dati negli studi è stato stabilito tra il 1942 e il 2005 (Tabelle 1 e 2).
Tabella 1. Caratteristiche degli studi caso-controllo inclusi nella review sistematica e nella meta-analisi della correlazione tra il consumo di prodotti lattiero-caseari e la comparsa del cancro della vescica negli adulti1
| Riferimenti | Paese | Studio/periodo di raccolta dei dati (anni) | Distribuzione dell'età (anni) | Numerosità del campione | Valutazione della dieta | Prodotti lattiero-caseari | Confronto tra i quantitativi di latticini | Numero di episodi di cancro alla vescica | Variabili di correzione | Rischio di bias2 |
|---|---|---|---|---|---|---|---|---|---|---|
| Mettlin and Graham (15) | Stati Uniti | 1957–1965 | ND | 1594 | Intervista | Latte | Porzioni al giorno (5 categorie) | 569 | Età | Basso |
| Risch et al. (16) | Canada | 1979–1982 | 35–79 | 1618 | Questionario | Latte | Porzioni al giorno (2 categorie) | 826 | Età, sesso, zona di residenza, durata del consumo di sigarette e storia di diabete | Alto |
| Slattery et al. (17) | Stati Uniti | 1977–1982 | 21–84 | 1308 | Intervista | Latte | Porzioni alla settimana (4 categorie) | 419 | Età, sesso, stato di fumatore, diabete ed infezioni alla vescica | Alto |
| Mettlin et al. (18) | Stati Uniti | 1982–1990 | 18–97 | 1478 | Questionario | Latte ad elevato contenuto di grassi Latte con il 2% di grasso Latte magro | Porzioni al giorno (3 categorie) | 178 | Età, sesso, storia di fumatore, livello di educazione e contea di provenienza | Basso |
| Riboli et al. (19) | Spagna | 1985–1986 | <80 | 1224 | Questionario sulla dieta | Latticini Burro/Panna | Quartili di assunzione | 432 | Età, sesso, fumatore, zona di residenza, calorie totali | Moderato |
| Wilkens et al. (20) | Stati Uniti | 1977–1986 | 30–93 | 783 | FFQ/32 punti | Latte | Terzili di assunzione | 261 | Età, livello di fumatore, pacchetti all’anno, impiegato in un lavoro ad alto rischio, consumo di vegetali a foglia verde negli uomini e consumo totale di vitamina C nelle donne | Alto |
| Lu et al. (21) | Taiwan | 1996–1997 | 67.5 | 200 | FFQ | Latte | Nessun consumo vs. consumo | 40 | Età, sesso, data di ammissione, storia familiare, etnia e livello di fumatore | Moderato |
| Wakai et al. (22) | Giappone | 1996–1999 | 20–99 | 592 | FFQ/97 punti | Latticini | Quartili di assunzione | 297 | Età, sesso, fumatore e storia occupazionale come cuoco | Basso |
| Balbi et al. (23) | Uruguay | 1998–1999 | 40–89 | 720 | FFQ/64 punti | Latticini, formaggio, burro, latte ad elevato contenuto di grassi | Terzili di assunzione | 144 | Età, BMI, calorie | Moderato |
| Ohashi et al. (24) | Giappone | 1997–1998 | 49–80 | 625 | Questionario | Latticini fermentati, Yakult | Porzioni al giorno (3 categorie) | 180 | Età, sesso e fumatore | Basso |
| Radosavljevi´c et al. (25) | Serbia | 1997–1999 | 26–81 | 260 | FFQ | Latte ad elevato contenuto di grassi, latte magro, yogurt | Nessun consumo vs. consumo | 130 | Età, sesso, fumatore e luogo di residenza | Basso |
| Wakai et al. (26) | Giappone | 1994–2000 | 20–79 | 744 | FFQ | Latte | Quartili di assunzione | 124 | Età, sesso, consumo complessivo di sigarette, anno della prima visita | Basso |
| Jiang et al. (27) | Stati Uniti | 1987–1999 | 25–64 | 3172 | Intervista | Latte | Quartili di assunzione | 1586 | Età, sesso, razza, livello di educazione, utilizzo di farmaci antinfiammatori non steroidei, assunzione di carotenoidi, numero di anni come parrucchiera/barbiere, status di fumatore, durata del consumo di sigarette ed intensità del consumo di sigarette | Basso |
| La Vecchia et al. (28) | Italia | 1985–1987 | 45–74 | 344 | FFQ | Latte, formaggio, burro | Terzili i assunzione | 163 | Età e sesso | Moderato |
| Hemelt et al. (29) | Cina | 2005–2008 | 65 | 824 | Intervista | Latte | Nessun consumo vs: -Consumo- < giornaliero o giornaliero- 1 tazza o > una tazza | 432 | Età, sesso, status di fumatore, frequenza ed intensità del consumo di sigarette- OR corretti | Basso |
| Brinkman et al. (30) | Belgio | 1999–2004 | 50–80 | 575 | FFQ Convalidato/322 punti | Latte Formaggio | Terzili i assunzione | 198 | Sesso, età, status di fumatore, numero di sigarette fumate al giorno, numero di anni come fumatore, esposizione durante il lavoro ad idrocarburi policiclici aromatici o ad amine aromatiche ed assunzione energetica | Basso |
| Isa et al. (31) | Cina | 2005–2008 | 40–80 | 956 | FFQ/35 punti | Latticini | Porzioni per settimana (5 categorie) | 487 | Sesso, età, status di fumatore, durata del consumo di sigarette, quantitativo di sigarette fumate e altri gruppi di alimenti | Basso |
| Ronco et al. (32) | Uruguay | 1996–2004 | 30–89 | 1735 | FFQ/64 punti | Latte, burro, formaggio | Terzili i assunzione | 225 | Età, zona di residenza, livello di educazione, BMI, fumatore, consumatore di alcool, energia totale e consumo totale di frutta e verdura | Basso |
1)ND, non disponibile; PHA, idrocarburi policiclici aromatici.
2)Rischio di bias valutato utilizzando lo strumento Quality Prognosis in Studies (QUIPS).
Tabella 2. Caratteristiche degli studi di coorte inclusi nella review sistematica e nella meta-analisi sulla correlazione tra il consumo di prodotti lattiero-caseari e il cancro della vescica nella popolazione adulta1
| Riferimenti | Paese | Studio/periodo di raccolta dei dati (anni) | Distribuzione dell'età | Numerosità del campione | Valutazione della dieta | Prodotti lattiero-caseari | Confrontro tra il quantitativo di latticini | Numero di episodi di cancro della vescica | Variabili di correzione | Rischio di bias2 |
|---|---|---|---|---|---|---|---|---|---|---|
| Ursin et al. (33) | Norvegia | 1967–1978 | 35–74 | 15.914 | Questionario sulla dieta | Latte | Porzioni al giorno (3 categorie) | 91 | Età, fumatore e zona di residenza | Alto |
| Chyou et al. (34) | Stati Uniti | 1942–1968 | 49–68 | 7995 | FFQ/17 elementi | Latte Gelato | Porzioni alla settimana (3 categorie) | 96 | Età e fumatore | Alto |
| Michaud et al.(35) | Stati Uniti | 1986–1996 | 40–75 | 47.909 | FFQ/131 elementi | Latte | Aumento di 240 ml | 252 | Età, verdura, fumatore, energia, regione geografica, frutta ed altre bevande | Basso |
| Nagano et al. (36) | Giappone | 1979–1993 | 50–80 | 38.54 | FFQ/22 elementi | Latte Burro/formaggio | Porzioni al giorno (3 categorie) | 114 | Età, BMI, genere, radiazioni, fumatore, calendario e livello di educazione | Moderato |
| Sakauchi et al.(37) | Giappone | 1988–1997 | 40–79 | 65.184 | FFQ/32 elementi | Latte Yogurt Formaggio Burro | Porzioni alla settimana (3 categorie) | 115 | Sesso, età e indice di fumatore | Moderato |
| Larsson et al. (38) | Svezia | 1987–1997 | 45–83 | 82.002 | FFQ/92 elementi | Latticini Formaggio Latte Latticini fermentati | Quartili di assunzione | 485 | Età, fumatore, sesso, assunzione energetica totale e livello di educazione | Basso |
| Keszei et al. (39) | Paesi Bassi | 1986–2002 | 55–69 | 120.852 | FFQ convalidato | Latticini Latticini non fermentati Latticini fermentati Formaggio Burro | Quintili di assunzione | 1549 | Età, sesso, fumatore, grassi, energia, carne, frutta, verdura e bevande | Basso |
| Ros et al. (40) | Europa | 1992–2000 | 53.3 | 233.236 | FFQ | Latte | Terzili di assunzione | 513 | Età, sesso, status di fumatore, intensità del fumare durante la vita, assunzione di energia proveniente da alimenti grassi e non | Basso |
1)JACC, Japan Collaborative Cohort; EPIC, European Prospective Investigation into Cancer and Nutrition.
2)Rischio di bias valutato utilizzando lo strumento Quality in Prognosis Studies (QUIPS).
L’età dei partecipanti inclusi variava dai 18 ai 99 anni, con un campione che oscillava tra i 200 ed i 233.236 partecipanti; 595.698 partecipanti sono stati inclusi nella meta-analisi (18.752 provenienti da studi caso-controllo e 576.946 da studi di coorte). Il numero dei casi di cancro alla vescica osservati era compreso tra 40 e 1586 in tutti gli studi. La maggior parte degli studi valutava il consumo di latticini tramite un FFQ, 4 studi utilizzavano l’intervista e 4 studi utilizzavano un questionario sulla dieta non specificato (i latticini tenuti in considerazione durante le valutazioni dietetiche negli studi sono riportati nella tabella supplementare 1). I prodotti lattiero-caseari riportati erano: latticini, latte, formaggio, burro, yogurt, panna e un latte fermentato (yakult). Uno studio, durante la valutazione della dieta, prendeva in esame (tra i prodotti lattiero-caseari) il latte al cacao e il budino (39). La maggior parte degli studi riportava dati per le categorie di consumo dei latticini, e solo uno studio riportava un’analisi dose-risposta del consumo di latticini. Gli studi inclusi nella review sistematica e nella meta-analisi presentavano, i seguenti valori medi approssimati relativi al consumo di latte: basso, ∼50 mL/die (∼4 mL/d in Asia, ∼57 mL/d negli Stati Uniti e ∼83 mL/d in Europa); medio, ∼227 mL/die (∼107 mL/d in Asia, ∼229 mL/d negli Stati Uniti e ∼306 mL/d in Europa); alto, ∼336 mL/die (∼200 mL/d in Asia, ∼348 mL/d negli Stati Uniti e ∼452 mL/d in Europa). I valori medi approssimati del consumo di latte intero erano: basso, ∼0 mL/die; medio, ∼110 mL/die; alto, ∼220 mL/die. Per i latticini fermentati, i valori medi approssimati del consumo erano: basso, ∼4 g/d (∼8.3 g/d in Asia e ∼0.0 g/d in Europa); medio, ∼67 g/d (∼36 g/d in Asia e ∼94 g/d in Europa); alto, ∼160 g/d (∼71 g/d in Asia e ∼249 g/d in Europa). Infine, per i latticini totali, i valori medi approssimati del consumo erano: basso, ∼201 g/d (∼16 g/d in Asia e ∼304 g/d in Europa); medio, ∼345 g/d (∼92 g/d in Asia e ∼515 g/d in Europa); alto, ∼545 g/d (∼195 g/d in Asia e ∼779 g/d in Europa). Tutti gli studi riportavano modelli corretti per diverse covariate. Tutti gli studi riportavano modelli corretti per l’età e la maggior parte degli studi includeva il sesso e lo status di fumatore. Altre correzioni comuni sono state effettuate per quanto riguardava la zona di residenza e per altri gruppi di alimenti. Nessuno studio includeva il consumo di integratori per il calcio durante le correzioni.
Qualità dello studio
Come valutato dallo strumento Quality in Prognosis Studies (Tabella supplementare 2), il 58% degli studi ha ottenuto un punteggio totale che corrispondeva ad un basso rischio di bias, il 23% aveva un rischio di bias moderato e solo il 19% aveva un rischio di bias elevato. L’attrition bias dello studio ha mostrato un rischio moderato o alto di bias nella maggior parte degli studi (65%). Al contrario, l’85% degli studi ha mostrato un basso rischio di bias nell’ambito dell’analisi statistica e del dominio di riferimento. Nessuno studio ha evidenziato un alto rischio di bias nella misurazione degli esiti, nell’analisi statistica e nel dominio di riferimento.
Meta-analisi
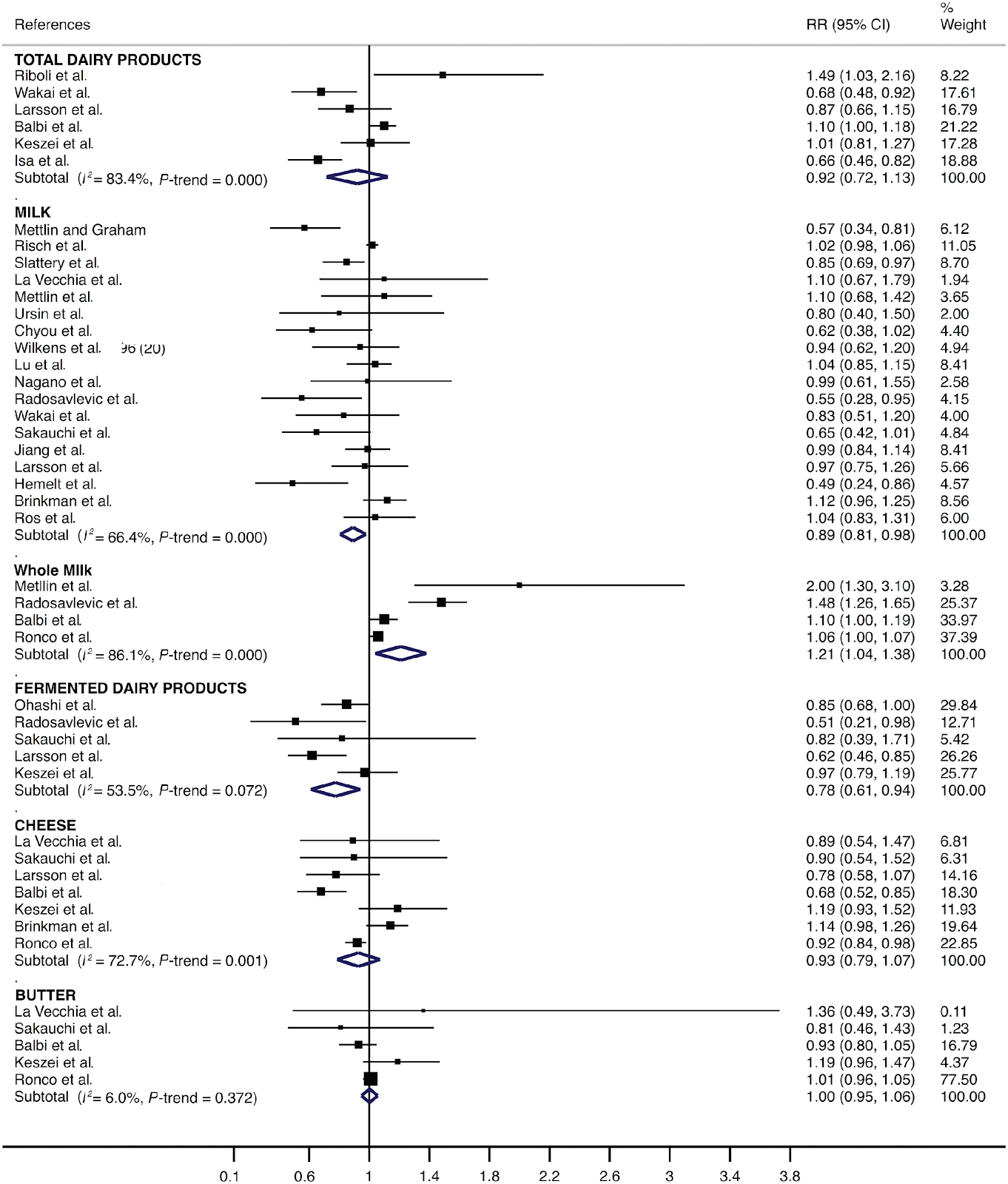
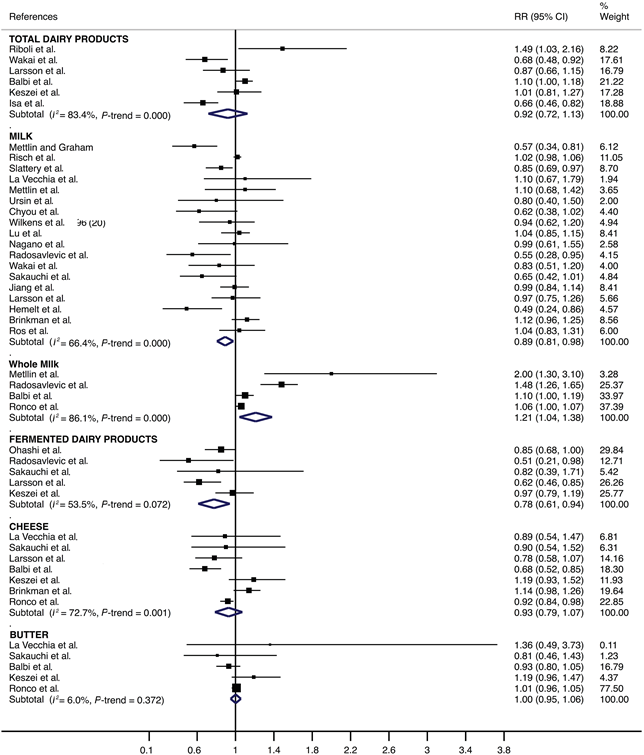
Per quanto riguarda i latticini totali il consumo medio, rispetto al consumo basso, è stato significativamente associato ad una diminuzione della stima pooled del rischio di sviluppare un cancro alla vescica (RR = 0.90; IC 95%: 0.81, 0.98); lo stesso valeva per il latte (RR = 0.90; IC 95%: 0.82, 0.98) e per i latticini fermentati (RR = 0.87; IC 95%: 0.79, 0.96). L’eterogeneità nelle stime del RR non è apparsa significativa per i latticini (I2 = 47.0%; P = 0.110) o per i latticini fermentati (I2 = 0.0%; P = 0.539) ed è risultata moderata per il latte (I2 = 57.9%; P = 0.004) (Figura 2). Inoltre, l’elevato consumo, rispetto al basso consumo, è stato significativamente correlato ad una diminuzione della stima pooled del rischio di cancro alla vescica per il latte (RR = 0.89; IC 95% CI: 0.81, 0.98) e per i latticini fermentati (RR = 0.78; IC 95%: 0.61, 0.94). Tuttavia un elevato consumo ,rispetto ad un consumo più basso, è stato significativamente associato ad un aumento della stima del rischio di cancro alla vescica per il latte intero (RR = 1.21; IC 95%: 1.04, 1.38). L’eterogeneità nelle stime dei RR è apparsa moderata per i latticini fermentati (I2 = 53.5%; P = 0.072) e rilevante per il latte (I2 = 66.4%; P < 0.001) e per il latte intero (I2 = 86.1%; P < 0.001) (Figura 3).
Figura 2. Forest plot che include il risk ratio del consumo medio di latticini, rispetto al consumo basso, in relazione allo sviluppo del cancro della vescica nella popolazione adulta.
Figura 3. Forest plot che include il risk ratio del consumo elevato di latticini, rispetto al consumo più basso, in relazione allo sviluppo del cancro della vescica nella popolazione adulta.
Analisi di sensibilità
Quando è stato esaminato l’effetto dei singoli studi (eliminando dall’analisi uno studio alla volta), dopo l’eliminazione dello studio di Ronco et al. (32) è stato riscontrato un significativo aumento del rischio di cancro alla vescica associato al consumo medio di latte intero rispetto ad un consumo basso. Invece, la significativa diminuzione del rischio di cancro alla vescica correlato ad un consumo medio di latte rispetto ad un consumo basso, è scomparsa dopo l’eliminazione degli studi di Hemelt et al. (29), di Mettlin et al. (18) e di Wilkens et al. (20). Infine, per quanto riguardava il consumo medio di formaggio vs. il consumo basso e per il consumo elevato di formaggio vs. il consumo basso, è stato individuato un rischio significativamente più basso di cancro alla vescica dopo la rimozione degli studi di Brinkman et al. (30) e di Keszei et al. (39).
Analisi di sottogruppo e meta-regressione
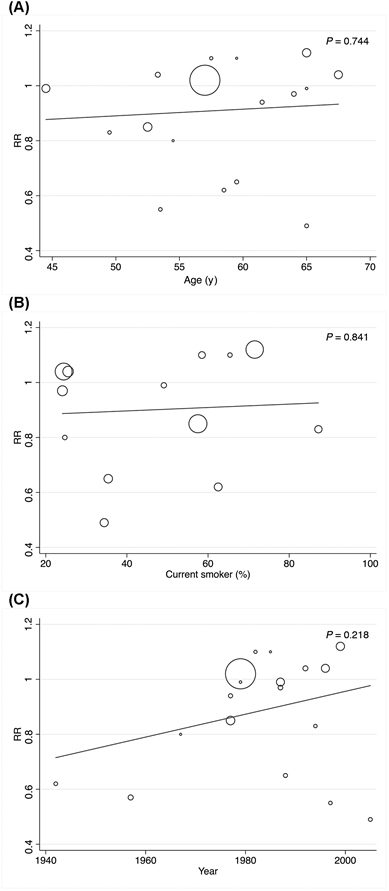
Quando le analisi sono state eseguite in base al genere, alla posizione geografica e alla tipologia di studio, avevamo studi sufficienti per eseguire soltanto un’analisi del consumo di latte. Il rischio di cancro alla vescica correlato al consumo medio di latte, se paragonato al rischio correlato ad un consumo basso, era significativamente protettivo nella regione asiatica (RR = 0.79; IC 95%: 0.59, 0.98, I2 = 56.8%) e per gli studi di coorte (RR = 0.85; IC 95%: 0.71, 0.99, I2 = 19.7%) (Tabella 3). È stato possibile applicare il modello di meta-regressione ad effetti random solamente al consumo di latte, dimostrando che l’età dei partecipanti (P = 0.744 per l’elevato consumo vs. il basso e P = 0.442 per il consumo medio vs. quello basso), la percentuale dei soggetti attualmente fumatori (P = 0.841 per l’elevato consumo vs. quello basso e P=0.078 per il consumo medio vs. quello basso) e l’anno di inizio dello studio (P = 0.218 per l’elevato consumo vs. quello basso e P=0.353 per il consumo medio vs. quello basso) non erano correlati alle stime RR pooled (Figure 4 e 5).
Tabella 3. Analisi di sottogruppo per il rischio di cancro alla vescica relative al consumo elevato di latte, rispetto a quello basso, e al consumo medio di latte, rispetto a quello basso, nella popolazione adulta, in base al genere, alla regione geografica e alla tipologia dello studio1
| Sottogruppo | n°| Consumo elevato vs. consumo basso RR (IC 95%) | I2 | P | Consumo medio vs. consumo basso RR (IC 95%) | I2 | P |
|
|---|---|---|---|---|---|---|---|
| Genere | |||||||
| Maschile | 4 | 0.86 (0.65, 1.07) | 78.7 | 0.003 | 0.93 (0.77, 1.08) | 34.6 | 0.217 |
| Femminile | 3 | 0.97 (0.85, 1.08) | 68.2 | 0.043 | — | — | |
| Localizzazione geografica | |||||||
| Americhe | 7 | 0.88 (0.76, 1.01) | 74.9 | 0.001 | 0.90 (0.79, 1.02) | 59.2 | 0.031 |
| Europa | 6 | 0.96 (0.79, 1.13) | 51.2 | 0.068 | 1.00 (0.87, 1.13) | 37.2 | 0.189 |
| Asia | 5 | 0.80 (0.57, 1.04) | 69.4 | 0.011 | 0.79 (0.59, 0.98) | 56.8 | 0.074 |
| Tipologia di studio | |||||||
| Caso-controllo | 12 | 0.90 (0.80, 1.01) | 72.4 | <0.001 | 0.92 (0.82, 1.02) | 67.3 | 0.002 |
| Di coorte | 6 | 0.86 (0.70, 1.02) | 31.6 | 0.199 | 0.85 (0.71, 0.99) | 19.7 | 0.289 |
1)P > 0.05 indica la presenza di eterogeneità tra gli studi
Figura 4. Analisi di meta-regressione ad effetti random per l’effetto moderatore dell’età, dello stato di attuale fumatore e dell’anno d’inizio dello studio nel rapporto tra il consumo di latte elevato, versus uno più basso, e il cancro della vescica nella popolazione adulta.
Figura 5. Analisi di meta-regressione ad effetti random per l’effetto moderatore dell’età, dello stato di attuale fumatore e dell’anno di inizio dello studio nel rapporto tra il consumo medio di latte, versus uno più basso, e il cancro della vescica nella popolazione adulta.
Bias di pubblicazione
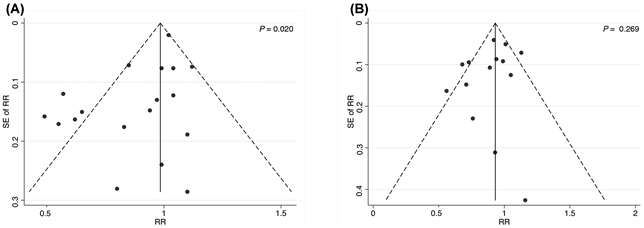
I bias di pubblicazione sono stati analizzati solo per il consumo di latte, perché in questa review sistematica e meta-analisi sono stati inclusi ≥10 articoli che prendevano in esame il latte. La prova dell’esistenza di un bias di pubblicazione è stata individuata, attraverso l’asimmetria del funnel plot e il test di Egger, solamente per il consumo di latte elevato vs. il consumo basso (P = 0.020) (Figura 6).
Figura 6. Valutazione dei potenziali bias di pubblicazione tramite il test di Egger per studi che trattano la correlazione tra l’elevato consumo di latte, rispetto a quello più basso, e tra il consumo medio di latte, rispetto a quello più basso, e la comparsa del cancro della vescica nella popolazione adulta.
Discussione
La presente meta-analisi ha riassunto le prove ottenute fino ad oggi sull’associazione tra il consumo di latte e latticini ed il rischio di cancro alla vescica, coinvolgendo un totale complessivo di 26 studi epidemiologici (8 di coorte e 18 caso-controllo) con una dimensione totale del campione ≤ 595.698, allo scopo di ottenere risultati più concreti. I risultati dello studio hanno suggerito che un consumo medio, rispetto ad un consumo basso, di latticini totali, di latte e di latticini fermentati è in grado di ridurre il rischio di comparsa del cancro della vescica. Inoltre, il rischio diminuisce anche in seguito ad un elevato consumo di latte e di latticini fermentati, rispetto a quanto succede con un consumo più basso. Al contrario, un elevato consumo di latte intero, rispetto ad uno più basso, è stato significativamente associato ad un aumento del rischio di cancro alla vescica. Non è stata osservata alcuna associazione con il consumo di burro e di formaggio o con il consumo elevato, rispetto a quello più basso, di qualsiasi altra tipologia di prodotti lattiero-caseari. I risultati del consumo medio di latticini fermentati non hanno mostrato alcuna eterogeneità. Tuttavia, come in entrambe le precedenti meta-analisi (5, 6), è stata rilevata una notevole eterogeneità negli altri risultati significativi, specialmente per quanto riguarda il latte intero per il quale l’eterogeneità è stata sostanziale. Diversi fattori potrebbero influenzare l’eterogeneità, tra cui l’età, il sesso, la posizione geografica, la tipologia di studio, il fumo e l’anno di inizio dello studio. La maggior parte degli studi inclusi in questa meta-analisi ha corretto i risultati per ≥ 3 dei più importanti fattori. Inoltre, sulla base dele analisi di sottogruppo condotte per il genere, la posizione geografica e la tipologia dello studio, la meta-analisi attuale ha indicato che una parte significativa dell’eterogeneità osservata nei risultati sul latte, potrebbe essere spiegata dalle differenze relative alla posizione geografica e alla tipologia dello studio intrapreso. Inoltre, il modello di meta-regressione ad effetti random ha mostrato che l’età dei partecipanti, la percentuale dei soggetti attualmente fumatori e l’anno di inizio dello studio non erano correlati alle stime pooled dei RR. L’analisi di sensibilità ha mostrato che il rischio significativamente più basso di sviluppo del cancro alla vescica correlato ad un consumo medio di latte, se confrontato con il consumo più basso, scompariva con la rimozione di 3 studi. Infine, è stata riscontrata una bias di pubblicazione per quanto riguardava il consumo di latte. Pertanto, i risultati devono essere interpretati con cautela. Nonostante l’eterogeneità ed il rischio di bias rilevate nella presente meta-analisi, 3 aspetti importanti meritano un’ulteriore discussione. Per prima cosa, i risultati hanno mostrato che la correlazione tra il consumo di latte e latticini ed il rischio di cancro alla vescica variava in modo significativo a seconda della tipologia di prodotto lattiero caseario analizzato. Questa meta-analisi ha evidenziato una diminuzione del rischio di cancro alla vescica associabile ad un consumo medio di latticini totali e ad un consumo medio ed elevato di latte e latticini fermentati, ma non è stata individuata alcuna correlazione per quanto riguarda il consumo di formaggio o burro. Dalle meta-analisi condotte in precedenza, Mao et al. (6) hanno suggerito un potenziale effetto protettivo (nei confronti del cancro della vescica) dell’elevato consumo di latte mentre Li et al. (5) hanno osservato (in una popolazione di studio ridotta) un’associazione inversa (solo negli Stati Uniti) tra il rischio di cancro alla vescica e il consumo elevato di latte e tra il rischio di cancro alla vescica e l’elevato consumo di latticini totali (in Giappone). Sono stati proposti diversi meccanismi biologici per spiegare la correlazione tra il consumo di latte e latticini e il rischio di cancro alla vescica. Il latte e i prodotti lattiero-caseari contengono diversi costituenti bioattivi potenzialmente protettivi nei confronti del cancro, uno dei quali è la vitamina D. Sebbene non contengano naturalmente vitamina D, il latte e i latticini arricchiti/fortificati con tale vitamina possono rappresentare una fonte significativa di tale composto(41). La vitamina D non solo impedisce la proliferazione e induce l’apoptosi nelle cellule tumorali, ma regola anche i soppressori tumorali legati al metabolismo e gli oncogeni (42). A questo proposito, è stata osservata una correlazione tra la carenza di vitamina D e l’aumento del rischio di cancro alla vescica (43). Infatti, le ultime meta-analisi inerenti hanno evidenziato che il mantenimento di sufficienti concentrazioni di 25-idrossi vitamina D nel siero è associato ad una diminuzione del rischio di cancro alla vescica (44, 45). Tuttavia, gli studi osservazionali inclusi nella presente meta-analisi non specificavano se i prodotti caseari analizzati fossero stati arricchiti con vitamina D. Anche altri composti bioattivi presenti nel latte e nei latticini, come il calcio (46, 47), la caseina e il lattosio, in quanto promotori della biodisponibilità del calcio (48) e della vitamina A (49), erano correlati ad una diminuzione del rischio di comparsa di alcune tipologie di tumori. Tuttavia, la misurazione del fattore prognostico degli studi primari inclusi nella presente meta-analisi non ha permesso di ottenere dati sull’assunzione dei nutrienti, per cui non è stato possibile stabilire una associazione in grado di sostenere l’esistenza di un contributo dei prodotti lattiero-caseari al precedente meccanismo biologico descritto. Oltre ai composti bioattivi, i latticini fermentati contengono probiotici, microrganismi vivi i cui effetti benefici per la salute umana sono stati ampiamente descritti (50). Il meccanismo d’azione dei probiotici favorisce il potenziamento delle risposte immunitarie aspecifiche e specifiche dell’ospite, la produzione di sostanze antimicrobiche e la competizione con i patogeni per i siti di legame (51). Finora non sono state individuate prove sulla possibile correlazione tra il consumo di latticini fermentati e il rischio di cancro alla vescica. Tuttavia, si è visto che i probiotici possiedono un effetto soppressivo sul cancro superficiale della vescica (52). Inoltre, durante uno studio prospettico condotto sulla popolazione adulta svedese, è stato osservato che un elevato consumo latte fermentato può ridurre il rischio di sviluppare il cancro alla vescica (38). A tal proposito, si è notato che i probiotici sono in grado di modificare la risposta immunitaria dell’ospite, conferendo protezione nei confronti delle risposte infiammatorie localizzate ed eccessive (53) e migliorando i tassi di incidenza del cancro alla vescica (54). Inoltre, alcuni studi sostengono l’ipotesi che il consumo abituale di batteri lattici possa promuovere l’immunità antitumorale (24). Il secondo importante risultato riguarda il contenuto di grassi del latte. Secondo i risultati osservati da Mao et al. (6) in questo studio, un elevato consumo di latte intero sembrerebbe far aumentare il rischio di sviluppare il cancro della vescica. Tuttavia, l’eterogeneità di questi dati era considerevole, quindi questo risultato dovrebbe essere considerato con cautela. Inoltre altri prodotti lattiero-caseari grassi, come il formaggio e il burro, non presentavano questa stessa associazione negativa. L’assunzione di grassi totali è stata correlata al rischio di cancro alla vescica (55). L’ipotesi principale a sostegno di un possibile effetto dei grassi sul rischio di comparsa del cancro, si basa sull’effetto intraluminale che hanno i prodotti della digestione dei grassi, tra cui gli acidi biliari secondari; tuttavia, i dati relativi all’uomo a supporto di questa ipotesi sono deboli (56). A tal proposito, c’è da dire che il latte e i latticini sono un’importante fonte alimentare di grassi totali e saturi (57). Infatti, la maggior parte dei lipidi del latte (97-98%) è costituita da TG o da esteri degli acidi grassi (58). Tuttavia, i grassi del latte contengono anche acido linoleico coniugato (CLA), uno stereoisomero geometrico e di posizione dell’acido linoleico, che si riscontra nel latte e nei prodotti lattiero-caseari e che proviene dai ruminanti (59). Si è visto che il CLA esercita un’attività antineoplastica e può avere proprietà antiproliferative o pro-apoptotiche. Infatti, il CLA è in grado di inibire in maniera evidente le linee cellulari maligne del cancro della vescica (60). Ciò è possibile soprattutto perché il CLA, con il suo isomero t10c12, inibisce il segnale del recettore del fattore di crescita insulino-simile (IGF-IR), che contribuisce alla diminuzione della proliferazione cellulare ed all’aumento dell’apoptosi delle cellule cancerose presenti nella vescica (61). In effetti, il consumo di latte intero è stato associato ad una diminuzione del rischio di alcune tipologie di tumori, come il cancro alla prostata. Al contrario, il latte totale e il latte a basso contenuto di grassi sono stati correlati ad un aumento del rischio di cancro alla prostata (62). Questi risultati discordanti sul contenuto dei grassi nei latticini, suggeriscono la necessità di ulteriori studi per chiarire la loro eventuale influenza sul rischio di cancro alla vescica. Attualmente, le raccomandazioni fatte da alcune delle più importanti istituzioni nel campo della nutrizione stabiliscono che il consumo di latticini a basso contenuto di grassi dovrebbe essere incoraggiato (63, 64). L’ultima questione sollevata si focalizza sulla quantità dei latticini consumati, che potrebbe giocare un ruolo importante nella comparsa del cancro della vescica. Ad oggi, le meta-analisi pubblicate per valutare la correlazione tra latte e latticini e cancro della vescica hanno misurato i più alti quantili di consumo confrontandoli con quelli più bassi (5, 6). Secondo le nostre conoscenze, questa è la prima meta-analisi che valuta , mettendoli a confronto, non solo l’elevato consumo con quello basso, ma anche il consumo medio con quello basso. Il presente studio ha osservato una diminuzione del rischio di cancro alla vescica con un consumo medio di latticini totali, di latte e di latticini fermentati e con un consumo elevato di latte e di latticini fermentati. Al contrario, Mao et al. (6) hanno osservato che soltanto il consumo elevato di latte, rispetto a quello più basso, era significativamente associato ad una diminuzione del rischio di cancro della vescica, mentre Li et al. (5) hanno osservato (solamente negli Stati Uniti) un’associazione inversa tra il rischio di cancro alla vescica e l’elevato consumo di latte, e (in Giappone) tra il rischio di cancro alla vescica e l’elevato consumo di latticini totali, in una popolazione di studio limitata. In questa meta-analisi non è stato possibile effettuare un’analisi dose-risposta. Per chiarire le quantità di latte e di latticini totali consumate incluse nelle categorie basso, medio o elevato consumo, sono stati calcolati i valori medi. Questi dati ci indicano che il consumo medio di latte (∼227 mL/die) e di latticini totali (∼345 g/die) è simile alle porzioni minime raccomandate nelle più importanti linee guida alimentari (64, 65). Ad esempio, le “ Dietary Guidelines for Americans” pubblicate dall’USDA e dall’US Department of Health and Human Services raccomandano ogni giorno, come parte di una dieta sana ed equilibrata, 3 porzioni del gruppo di alimenti “latte, yogurt e formaggio”. Una porzione può essere costituita, ad esempio, da 200 ml di latte, da 125 g di yogurt, o da 25 g di formaggio a pasta dura (64), quindi la porzione minima raccomandata per i latticini totali, compresi in “latte, yogurt e formaggio”, è di 350 g/die. Pertanto, per quanto riguarda i risultati ottenuti dalla presente meta-analisi, la combinazione di una porzione di latte e di latticini fermentati potrebbe essere un’opzione adeguata per ottenere benefici circa una diminuzione del rischio di cancro alla vescica. Tuttavia, durante l’analisi del consumo di latte suddiviso per sottogruppi (in questo caso la posizione geografica) è stata osservata una diminuzione del rischio di cancro alla vescica con un consumo medio solamente nella regione asiatica. La media approssimativa calcolata nella popolazione asiatica era inferiore a quella dell’America o dell’Europa, quindi i risultati riportati nel presente studio potrebbero richiedere una riflessione sulla corretta raccomandazione giornaliera di latte. Tuttavia, se parliamo di popolazione asiatica, dobbiamo tenere in considerazione anche altri fattori, come il possibile ruolo giocato dalle loro abitudini alimentari sane, il diverso stile di vita e le altre differenze genetiche (66). Ad esempio, l’intolleranza al lattosio si manifesta nel 60% delle persone in Europa, nel 50-80% delle persone di origine ispanica, in quelle provenienti dal sud dell’India e nelle persone di colore e quasi nel 100% delle persone in Asia (67). Infine, per quanto riguarda i prodotti lattiero-caseari, è importante sottolineare come il consumo di latte nei paesi sviluppati sia calato leggermente negli ultimi decenni. Un recente aggiornamento dell’USDA (68) ha confermato che il consumo di latte è diminuito del 25% dal 1996 al 2016 (68). Questa diminuzione osservata potrebbe essere il risultato di campagne che promuovono l’idea che il latte vaccino non sia adatto per l’uomo (69). Negli ultimi anni, gruppi influenti hanno criticato il latte e i latticini ed hanno consigliato di limitare il consumo di alimenti a base di latte, a causa dei pochi benefici e dei potenziali danni che si potrebbero avere per gli esseri umani (70, 71). Tuttavia, le prove scientifiche a nostra disposizione supportano il consumo di latte e di latticini in quanto alimenti che contribuiscono a soddisfare le raccomandazioni nutrizionali e che possono proteggerci dalle malattie croniche più diffuse e dal rischio di mortalità, con pochissimi effetti negativi segnalati (72-74). I risultati ottenuti dalla presente meta-analisi contribuiscono ad ampliare questo insieme di prove. In quanto review sistematica e meta-analisi di studi pubblicati in precedenza, il nostro studio ha diversi limiti che devono essere tenuti in considerazione quando analizziamo i suoi contributi. In primo luogo, poiché sono stati inclusi sia gli studi caso-controllo che quelli di coorte, esiste un’ampia variabilità tra gli studi e le differenze metodologiche nella progettazione degli studi potrebbero influenzare i risultati a causa della grande variabilità inclusa nell’analisi. Inoltre, i risultati sul consumo di latte totale e di latticini si basavano sulle risposte ad un unico questionario che è stato fornito soltanto una volta. Un secondo limite è che l’eterogeneità potrebbe essere dovuta al consumo di latte e latticini che comprendono un’insieme di differenti prodotti che possono variare tra gli studi. Infine altri importanti fattori della dieta, e lo stile di stile di vita, potrebbero aver influenzato i risultati, dato che non sono stati tenuti in considerazione nella maggior parte degli studi primari inclusi. Pertanto, questi risultati devono essere interpretati con cautela. In conclusione, i risultati ottenuti dalla presente meta-analisi suggeriscono una diminuzione del rischio di cancro della vescica correlato ad un consumo medio di latticini totali (∼345 g/die) e ad consumo medio ed elevato di latte (∼227 mL/die, ∼336 mL/d) e di latticini fermentati (∼67 g/die, ∼160 g/die).Inoltre, è stato osservato un aumento del rischio di cancro alla vescica in seguito ad un elevato consumo di latte intero (∼220 mL/die), anche se i risultati devono essere interpretati con cautela. Ad oggi, il consumo di latte e di latticini dovrebbe seguire le raccomandazioni dietetiche formulate dalle autorità competenti di ogni paese. La combinazione quotidiana di latte e latticini fermentati potrebbe essere un’opzione salutare per ridurre il rischio di cancro della vescica. In futuro sono necessarie ulteriori ricerche per chiarire le dimensioni della giusta porzione da consigliare ed il ruolo da attribuire al contenuto di grassi e alle differenti localizzazioni geografiche, per riuscire a tracciare delle raccomandazioni utili a ridurre il rischio di cancro della vescica.
Riconoscimenti
Le responsabilità degli autori erano le seguenti: LMB: ha redatto il manoscritto originale; IC-R e LMB: hanno condotto la strategia di ricerca, la selezione degli studi, l’estrazione dei dati e la valutazione della loro qualità; CS e BL-P: sono stati coinvolti come terzi in caso di disaccordo durante l’estrazione dei dati e la valutazione della loro qualità; IC-R: ha condotto le analisi statistiche; BL-P: ha partecipato all’interpretazione e all’analisi dei dati ottenuti; CG-C: aveva la responsabilità primaria del contenuto finale del manoscritto. Tutti gli autori hanno letto ed approvato il manoscritto finale.
Copyright © American Society for Nutrition 2019. Tutti i diritti riservati. Adv Nutr 2019;10:S224–S238;
doi: https://doi.org/10.1093/advances/nmy119
Milk and Dairy Product Consumption and Bladder Cancer Risk: A Systematic Review and Meta-Analysis of Observational Studies
Laura M Bermejo1, Bricia López-Plaza1, Cristina Santurino1, Iván Cavero-Redondo2 e Carmen Gómez-Candela1,3,4
1)Nutrition and Functional Food Research Group, Hospital La Paz Institute for Health Research (IdiPAZ), Madrid, Spagna.
2)Health and Social Research Center, Universidad de Castilla-LaMancha, Cuenca, Spagna.
3)La Paz University Hospital, Madrid, Spagna.
4)Medicine Department, Universidad Autónoma de Madrid, Madrid, Spagna.
Riferimenti
1. Ferlay J, Soerjomataram I, Dikshit R, Eser S, Mathers C, Rebelo M, Parkin DM, Forman D, Bray F. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012. Int J Cancer 2015;136:E359–86.
2. Letašiova S, Medveˇdova A, Šovˇcikova A, Dušinska M, Volkovova K, Mosoiu C, Bartonova A. Bladder cancer, a review of the environmental risk factors. Environ Heal 2012;11:S11.
3. Research.WCRFII for C. Diet, Nutrition, Physical Activity and Bladder Cancer 2015.
4. Silberstein JL, Parsons JK. Evidence-based principles of bladder cancer and diet. Urology 2010;75:340–6.
5. LiF,AnS,ZhouY,LiangZ, JiaoZ, JingY,WanP,ShiX, TanW.Milkand dairy consumption and risk of bladder cancer: ameta-analysis. Urology 2011;78:1298–305.
6. Mao Q-Q, Dai Y, Lin Y-W, Qin J, Xie L-P, Zheng X-Y. Milk consumption and bladder cancer risk: a meta-analysis of published epidemiological studies. Nutr Cancer 2011;63:1263–71.
7. World Cancer Research Fund/American Institute for Cancer Research. Diet, nutrition, physical activity and bladder cancer. In: Continuous Update Project Expert Report 2018: Diet, Nutrition, Physical Activity and Cancer: A Global Perspective. London: WCRF; 2018. p. 1–38. Available from: https://www.wcrf.org/sites/default/files/Bladdercancer-report.pdf.
8. Stroup DF, Berlin JA, Morton SC, Olkin I, Williamson GD, Rennie D, Moher D, Becker BJ, Sipe TA, Thacker SB. Meta-analysis of observational studies in epidemiology: a proposal for reporting. Metaanalysis Of Observational Studies in Epidemiology (MOOSE) group. JAMA 2000;283:2008–12.
9. Higgins JPT, Green S, editors. Cochrane Handbook for Systematic Reviews of Interventions. Version 5.1.0 [Internet]. The Cochrane Collaboration; 2011. Available from: http://handbook.cochrane.org.
10. Hayden JA, van der Windt DA, Cartwright JL, Cote P, Bombardier C. Assessing bias in studies of prognostic factors. Ann Intern Med 2013;158:280–6.
11. DerSimonian R, Kacker R. Random-effects model for meta-analysis of clinical trials: an update. Contemp Clin Trials 2007;28:105–14.
12. Higgins JPT, Thompson SG. Quantifying heterogeneity in a metaanalysis. Stat Med 2002;21:1539–58.
13. Thompson SG, Sharp SJ. Explaining heterogeneity in meta-analysis: a comparison of methods. Stat Med 1999;18:2693–708.
14. EggerM,Davey Smith G, Schneider M,Minder C. Bias in meta-analysis detected by a simple, graphical test. BMJ 1997;315:629–34.
15. Mettlin C, GrahamS. Dietary risk factors in human bladder cancer.Am J Epidemiol 1979;110:255–63.
16. Risch HA, Burch JD, Miller AB, Hill GB, Steele R, Howe GR. Dietary factors and the incidence of cancer of the urinary bladder. Am J Epidemiol 1988;127:1179–91.
17. Slattery ML,West DW, Robison LM. Fluid intake and bladder cancer in Utah. Int J Cancer 1988;42:17–22.
18. Mettlin CJ, Schoenfeld ER, Natarajan N. Patterns of milk consumption and risk of cancer. Nutr Cancer 1990;13:89–99.
19. Riboli E, Gonzalez CA, Lopez-Abente G, Errezola M, Izarzugaza I, Escolar A, Nebot M, Hemon B, Agudo A. Diet and bladder cancer in Spain: a multi-centre case-control study. Int J Cancer 1991;49:214–19.
20. Wilkens LR, Kadir MM, Kolonel LN, Nomura AM, Hankin JH. Risk factors for lower urinary tract cancer: the role of total fluid consumption, nitrites and nitrosamines, and selected foods. Cancer Epidemiol Biomarkers Prev 1996;5:161–6.
21. Lu CM, Lan SJ, Lee YH, Huang JK, Huang CH, Hsieh CC. Tea consumption: fluid intake and bladder cancer risk in southern Taiwan. Urology 1999;54:823–8.
22. Wakai K, Takashi M, Okamura K, Yuba H, Suzuki K, Murase T, Obata K, Itoh H, Kato T, Kobayashi M, et al. Foods and nutrients in relation to bladder cancer risk: a case-control study in Aichi Prefecture, central Japan. Nutr Cancer 2000;38:13–22.
23. Balbi JC, Larrinaga MT, De Stefani E, Mendilaharsu M, Ronco AL, Boffetta P, Brennan P. Foods and risk of bladder cancer: a case-control study in Uruguay. Eur J Cancer Prev 2001;10:453–8.
24. Ohashi Y, Nakai S, Tsukamoto T, Masumori N, Akaza H, Miyanaga N, Kitamura T, Kawabe K, Kotake T, Kuroda M, et al. Habitual intake of lactic acid bacteria and risk reduction of bladder cancer. Urol Int 2002;68:273–80.
25. Radosavljevi´c V, Jankovi´c S, Marinkovi´c J, Djoki´c M. Fluid intake and bladder cancer. A case control study. Neoplasma 2003;50:234–8.
26. Wakai K, Hirose K, Takezaki T, Hamajima N, Ogura Y, Nakamura S, Hayashi N, Tajima K. Foods and beverages in relation to urothelial cancer: case-control study in Japan. Int J Urol 2004;11:11–19.
27. Jiang X, Castelao JE, Groshen S, Cortessis VK, Shibata DK, Conti DV, Gago-Dominguez M. Water intake and bladder cancer risk in Los Angeles County. Int J Cancer 2008;123:1649–56.
28. LaVecchia C, Negri E,Decarli A, D’Avanzo B, Liberati C, Franceschi S. Dietary factors in the risk of bladder cancer. Nutr Cancer 1989;12:93– 101.
29. Hemelt M, Hu Z, Zhong Z, Xie L-P,Wong YC, Tam P-C, Cheng KK, Ye Z, Bi X, Lu Q, et al. Fluid intake and the risk of bladder cancer: results from the South and East China case-control study on bladder cancer. Int J Cancer 2010;127:638–45.
30. Brinkman MT, Buntinx F, Kellen E, Dagnelie PC, Van Dongen MCJM, Muls E, Zeegers MP. Dietary intake of micronutrients and the risk of developing bladder cancer: results from the Belgian case-control study on bladder cancer risk. Cancer Causes Control 2011;22:469–78.
31. Isa F, Xie L-P, Hu Z, Zhong Z, Hemelt M, Reulen RC, Wong YC, Tam P-C, Yang K, Chai C, et al. Dietary consumption and diet diversity and risk of developing bladder cancer: results from the South and East China case-control study. Cancer Causes Control 2013;24: 885–95.
32. Ronco AL,Mendilaharsu M, Boffetta P, Deneo-Pellegrini H, De Stefani E. Meat consumption, animal products, and the risk of bladder cancer: a case-control study in Uruguayan men. Asian Pac J Cancer Prev 2014;15:5805–9.
33. Ursin G, Bjelke E, Heuch I, Vollset SE. Milk consumption and cancer incidence: a Norwegian prospective study. Br J Cancer 1990;61:454–9.
34. Chyou PH, Nomura AM, Stemmermann GN. A prospective study of diet, smoking, and lower urinary tract cancer. Ann Epidemiol 1993;3:211–16.
35. Michaud DS, Spiegelman D, Clinton SK, Rimm EB, Curhan GC,Willett WC,Giovannucci EL. Fluid intake and the risk of bladder cancer inmen. N Engl J Med 1999;340:1390–7.
36. Nagano J, Kono S, Preston DL, Moriwaki H, Sharp GB, Koyama K, Mabuchi K. Bladder-cancer incidence in relation to vegetable and fruit
consumption: a prospective study of atomic-bomb survivors. Int J Cancer 2000;86:132–8.
37. Sakauchi F, Mori M, Washio M, Watanabe Y, Ozasa K, Hayashi K, Miki T, Nakao M, Mikami K, Ito Y, et al. Dietary habits and risk of urothelial cancer incidence in the JACC Study. J Epidemiol 2005;15(Suppl 2):S190–5.
38. Larsson SC, Andersson S-O, Johansson J-E, Wolk A. Cultured milk, yogurt, and dairy intake in relation to bladder cancer risk in a prospective study of Swedish women and men. Am J Clin Nutr 2008;88:1083–7.
39. Keszei AP, Schouten LJ, Goldbohm RA, van den Brandt PA. Dairy intake and the risk of bladder cancer in the Netherlands Cohort Study on Diet and Cancer. Am J Epidemiol 2010;171:436–46.
40. Ros MM, Bas Bueno-de-Mesquita HB, Buchner FL, Aben KKH, Kampman E, Egevad L, Overvad K, Tjonneland A, Roswall N, Clavel- Chapelon F, et al. Fluid intake and the risk of urothelial cell carcinomas in the European Prospective Investigation into Cancer and Nutrition (EPIC). Int J Cancer 2011;128:2695–708.
41. Spiro A, Buttriss JL. Vitamin D: an overview of vitamin D status and intake in Europe. Nutr Bull 2014;39:322–50.
42. Abu el Maaty M, Wolfl S. Vitamin D as a novel regulator of tumor metabolism: insights on potential mechanisms and implications for anti-cancer therapy. Int J Mol Sci 2017;18:2184.
43. ZhangH, Zhang H,WenX, Zhang Y,WeiX, Liu T.VitaminDdeficiency and increased risk of bladder carcinoma: a meta-analysis. Cell Physiol Biochem 2015;37:1686–92.
44. Zhao Y, Chen C, Pan W, Gao M, He W, Mao R, Lin T, Huang J. Comparative efficacy of vitamin D status in reducing the risk of bladder cancer: a systematic review and network meta-analysis. Nutrition 2016;32:515–23.
45. Liao Y, Huang J-L, Qiu M-X,Ma Z-W. Impact of serumvitamin D level on risk of bladder cancer: a systemic review and meta-analysis. Tumor Biol 2015;36:1567–72.
46. Cho E, Smith-Warner SA, Spiegelman D, Beeson WL, van den Brandt PA, Colditz GA, Folsom AR, Fraser GE, Freudenheim JL, Giovannucci E, et al. Dairy foods, calcium, and colorectal cancer: a pooled analysis of 10 cohort studies. J Natl Cancer Inst 2004;96:1015–22.
47. Chen P,Hu P, Xie D, Qin Y,Wang F,Wang H.Meta-analysis of vitamin D, calciumand the prevention of breast cancer. Breast Cancer Res Treat 2010;121:469–77.
48. Gueguen L, Pointillart A. The bioavailability of dietary calcium. J Am Coll Nutr 2000;19:119S–36S.
49. Park Y, Spiegelman D, Hunter DJ, Albanes D, Bergkvist L, Buring JE, Freudenheim JL, Giovannucci E, Goldbohm RA, Harnack L, et al. Intakes of vitamins A, C, and E and use of multiple vitamin supplements and risk of colon cancer: a pooled analysis of prospective cohort studies. Cancer Causes Control 2010;21:1745–57.
50. George Kerry R, Patra JK, Gouda S, Park Y, Shin H-S, Das G. Benefaction of probiotics for human health: a review. J Food Drug Anal 2018;26:927–39.
51. Singh VP, Sharma J, Babu S, Rizwanulla, Singla A. Role of probiotics in health and disease: a review. J Pak Med Assoc 2013;63:253–7.
52. AsoY, AkazanH. Prophylactic effectof a Lactobacillus casei preparation on the recurrence of superficial bladder cancer. Urol Int 1992;49:125–9.
53. Mombelli B, Gismondo MR. The use of probiotics in medical practice. Int J Antimicrob Agents 2000;16:531–6.
54. Feyisetan O, Tracey C, Hellawell GO. Probiotics, dendritic cells and bladder cancer. BJU Int 2012;109:1594–7.
55. La Vecchia C, Negri E. Nutrition and bladder cancer. Cancer Causes Control 1996;7:95–100.
56. Newmark HL,WargovichMJ, Bruce WR. Colon cancer and dietary fat, phosphate, and calcium: a hypothesis. J Natl Cancer Inst 1984;72:1323–5.
57. Nettleton JA, Brouwer IA, Geleijnse JM, Hornstra G. Saturated fat consumption and risk of coronary heart disease and ischemic stroke: a science update. Ann Nutr Metab 2017;70:26–33.
58. Norat T, Riboli E. Dairy products and colorectal cancer. A review of possible mechanisms and epidemiological evidence. Eur J Clin Nutr 2003;57:1–17.
59. Belury MA. Inhibition of carcinogenesis by conjugated linoleic acid: potential mechanisms of action. J Nutr 2002;132:2995–8.
60. Maggiora M, Bologna M, Ceru MP, Possati L, Angelucci A, Cimini A, Miglietta A, Bozzo F, Margiotta C, Muzio G, et al. An overview of the effect of linoleic and conjugated-linoleic acids on the growth of several human tumor cell lines. Int J Cancer 2004;112:909–19.
61. Jung JI, Cho HJ, KimJ, Kwon DY, Park JHY. trans-10,cis-12 conjugated linoleic acid inhibits insulin-like growth factor-I receptor signaling in TSU-Pr1 human bladder cancer cells. J Med Food 2010;13:13–19.
62. Aune D, Navarro Rosenblatt DA, Chan DS, Vieira AR, Vieira R, Greenwood DC, Vatten LJ, Norat T. Dairy products, calcium, and prostate cancer risk: a systematic review and meta-analysis of color studies. Am J Clin Nutr 2015;101:87–117.
63. Roth N, Knai C. Food based dietary guidelines in the WHO European Region [Internet]. Copenhagen: World Health Organization; 2003. p. 1–38. Available from: http://www.euro.who.int/__data/assets/pdf_ file/0017/150083/E79832.pdf.
64. US Department of Health and Human Services and USDA. 2015–2020 dietary guidelines for Americans. 8th ed. December 2015. Available from: http://health.gov/dietaryguidelines/2015/guidelines/.
65. FAO/WHO. Food-based dietary guidelines [Internet]. [cited 20 Sep, 2018]. Rome: FAO; 2018. Available from: http://www.fao.org/nutrition/ education/food-based-dietary-guidelines/en/.
66. Kelly M. The nutrition transition in developing Asia: dietary change, drivers and health impacts [Internet]. In: Jackson P, SpiessWEL, Sultana F, editors. Eating, drinking: surviving: The International year of global understanding – IYGU. Cham: Springer; 2016 [cited 12 Jul, 2018]. p. 83–90. Available from: http://link.springer.com/10.1007/978-3-319-42468-2_9.
67. Bhatnagar S, Aggarwal R. Lactose intolerance. BMJ 2007;334:1331–2.
68. USDA, Economic Research Service. Dairy Data [Internet]. 2018 [cited 29 Jun, 2018]. Available from: https://www.ers.usda.gov/data-products/dairy-data/.
69. Fischer WJ, Schilter B, Tritscher AM, Stadler RH. Contaminants of milk and dairy products: contamination resulting from farm and dairy practices. In: Fuquay JW, editor. Encyclopedia of dairy sciences. 2nd ed. San Diego, CA: Elsevier; 2011. p. 887–897.
70. Skerrett PJ. Harvard to USDA: check out the healthy eating plate [Internet]. Harvard Health Blog. Cambridge, MA: Harvard Health Publishing; 2016 [cited 29 Jun, 2018]. Available from: https://www.health.harvard.edu/blog/harvard-to-usda-check-outthe-healthy-eating-plate-201109143344.
71. Harvard researchers continue to support their healthy eating plate [Internet]. Cambridge, MA: Harvard Health Publishing; 2017 [cited 29 Jun, 2018]. Available from: https://www.health.harvard.edu/plate/harvard-researchers-launch-healthy-eating-plate.
72. Thorning TK, Raben A, Tholstrup T, Soedamah-Muthu SS, Givens I, Astrup A. Milk and dairy products: good or bad for human health? An assessment of the totality of scientific evidence. Food Nutr Res 2016;60:32527.
73. Guo J,AstrupA, Lovegrove JA,Gijsbers L,GivensDI,Soedamah-Muthu SS. Milk and dairy consumption and risk of cardiovascular diseases and all-cause mortality: dose–response meta-analysis of prospective color studies. Eur J Epidemiol 2017;32:269–87.
74. Mullie P, Pizot C, Autier P. Daily milk consumption and all-cause mortality, coronary heart disease and stroke: a systematic review and meta-analysis of observational cohort studies. BMC Public Health 2016;16:1236.