Lo iodio, micronutriente presente nell’organismo umano e concentrato per la quasi totalità nella ghiandola tiroidea, è indispensabile per il corretto funzionamento di questo importante organo. Gli ormoni prodotti dalla tiroide (tiroxina e triiodotironina) contengono iodio nella loro struttura chimica e la loro sintesi dipende dalla disponibilità di adeguate quantità di tale minerale che può essere introdotto soltanto attraverso la dieta. Gli ormoni tiroidei sono indispensabili per il corretto funzionamento del metabolismo cellulare e per il regolare sviluppo di numerosi organi, in particolar modo del cervello e delle sue funzioni neurologiche e cognitive. Per evitare la comparsa di disturbi da carenza iodica, l’assunzione di iodio deve essere adeguata durante tutte le fasi della vita. Nello specifico, particolare attenzione deve essere posta durante le fasi di gravidanza, allattamento e infanzia in quanto sono i momenti in cui le manifestazioni cliniche conseguenti all’ipotiroidismo (insufficiente produzione di ormoni tiroidei) possono portare ad effetti maggiormente dannosi. Tra i più frequenti disordini da carenza iodica vi è la comparsa del gozzo negli adulti, ovvero l’ingrossamento della tiroide, mentre nelle fasi di sviluppo del feto e del neonato la carenza di iodio può causare danni irreversibili al cervello e al sistema nervoso con un conseguente ritardo mentale permanente, definito come cretinismo (Underwood, 1977; EFSA, 2014).
A tal proposito, l’Organizzazione Mondiale della Sanità (OMS) ha raccomandato un’assunzione giornaliera di iodio di 150 µg per adolescenti e adulti che sale fino a 200 µg al giorno per le donne in stato di gravidanza e allattamento (WHO/FAO, 2004). La maggior parte delle persone non riesce però a soddisfare tale fabbisogno con le normali abitudini alimentari (Zimmermann, 2011); pertanto, al fine di raggiungere gli standard proposti dall’OMS, con la legge n. 55/2005 il nostro Paese ha introdotto un programma nazionale di iodoprofilassi che prevede l’obbligatoria disponibilità di sale iodato in tutti i punti vendita, nonché il suo impiego nella ristorazione collettiva e nelle preparazioni dell’industria alimentare. Se da un lato tale provvedimento ha portato alla pressoché scomparsa delle conseguenze cliniche più gravi del deficit iodico, il solo consumo di sale iodato come fonte di iodio può non essere sufficiente a coprire l’intero fabbisogno di questo micronutriente, e ancora oggi una parte rilevante della popolazione soffre di moderata carenza iodica. Per contro, è altresì importante tenere presente che un abuso del consumo di sale è caldamente sconsigliato a causa della presenza di sodio che in quantità eccessive porta ad altrettante conseguenze negative sulla salute, quali ipertensione e malattie cardiovascolari. Per adempiere dunque alle dosi consigliate dalle linee guida, la soluzione è quella di adottare una dieta varia e bilanciata che preveda al suo interno alimenti ricchi di iodio. Vale la pena sottolineare infatti che la fonte principale di iodio per l’organismo è rappresentata proprio dagli alimenti che hanno un contenuto di iodio estremamente variabile. Pesci di mare e crostacei sono naturalmente più ricchi di iodio, seguiti da latte, prodotti lattiero-caseari e uova. È noto come, soprattutto nelle regioni dell’entroterra, le comuni abitudini alimentari non contemplino un regolare consumo di pesce e crostacei, pertanto il latte e i suoi derivati diventano una fonte primaria di questo micronutriente per gran parte delle regioni italiane ed europee.
La presenza di iodio nel latte è dovuta in primo luogo all’alimentazione delle bovine, ed è dunque variabile in funzione della stagione e del sistema di allevamento; per consentire un’adeguata produzione di ormoni tiroidei, nonché il normale sviluppo del feto e del vitello, è inoltre previsto anche un supplemento di iodio alla normale razione attraverso la somministrazione di integratori minerali. Anche le pratiche di sanitizzazione delle mammelle delle bovine con disinfettanti a base di iodio possono condizionare il contenuto finale di iodio nel latte (van der Reijden, 2018).
L’estrema importanza che la presenza di tale minerale ha per la salute umana, il fatto che la sua carenza rappresenti ancora oggi un rilevante problema di salute pubblica e le numerose variabili che ne influenzano la concentrazione nel latte, giustificano il grande interesse della comunità scientifica per tale argomento (es. Naozuka e coll., 2003; Hedayati e coll., 2007; Reid e coll., 2008).
Il presente lavoro intende proporre una metodica di riferimento per la quantificazione di iodio nel latte basato sulla spettrometria di massa ICP-MS (inductively coupled plasma mass spectrometry). La metodica si caratterizza in primo luogo per l’elevata sensibilità e precisione che per la prima volta sono state indagate in termini di ripetibilità e riproducibilità, dimostrando che i risultati ottenuti non sono influenzati da condizioni quali operatore o tempi di analisi. Un altro vantaggio da considerare è la velocità di preparazione dei campioni: escludendo il riscaldamento iniziale del latte, l’intera preparazione richiede circa 1,5 ore rispetto alle 6 o più ore di altri protocolli. Non per ultimo è doveroso sottolineare come per la prima volta il metodo proposto abbia indagato la concentrazione di iodio nel latte di diverse specie lattifere, oltre che l’effetto che i trattamenti tecnologici di pastorizzazione, sterilizzazione e scrematura possono avere sul contenuto finale di iodio.
Per quanto riguarda l’effetto dei trattamenti tecnologici, i risultati ottenuti hanno consentito di osservare che il latte pastorizzato parzialmente scremato presenta la più alta concentrazione di iodio, mentre il latte crudo evidenzia il minor contenuto (Figura 1).
Figura 1. Contenuto di iodio (µg/kg) in latte crudo (LC), latte pastorizzato intero (LPI), latte pastorizzato parzialmente scremato (LPS), latte UHT intero (LUI) e latte UHT parzialmente scremato (LUS).
Si può avanzare un’ipotesi esemplificativa di tali risultati tenendo in considerazione il fatto che lo iodio e i suoi composti sono solubili in acqua ed il latte parzialmente scremato presenta effettivamente una maggiore frazione solubile a parità di volume di latte. Inoltre, avendo il latte pastorizzato parzialmente scremato il più alto rapporto proteine/caseine, i risultati del presente studio suggeriscono che la concentrazione di iodio potrebbe essere almeno in parte associata alle micelle caseiniche, come avviene anche per la maggior parte dei minerali del latte (Franzoi e coll., 2018). È dunque possibile che le principali variazioni del contenuto di iodio nel latte siano associate alla composizione chimica del latte stesso, piuttosto che ai trattamenti tecnologici in senso stretto.
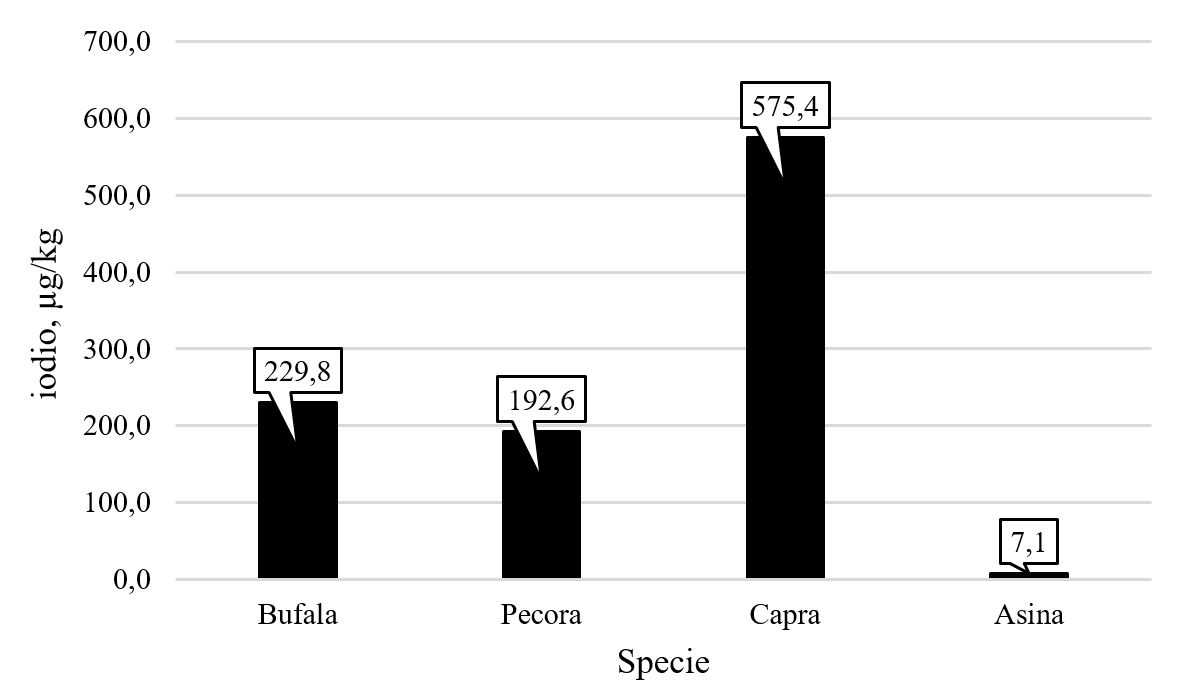
In Figura 2 sono presentati i risultati del contenuto di iodio nel latte di bufala, pecora, capra e asina. Le diverse specie hanno mostrato un contenuto di iodio pressoché confrontabile, mentre una concentrazione particolarmente bassa di iodio è stata osservata nel latte di asina, unica specie monogastrica considerata in questo studio.
Figura 2. Contenuto di iodio (µg/kg) in latte di bufala, pecora, capra e asina.
Relativamente alle specie di ruminanti, il maggior contenuto di iodio è stato ritrovato nel latte di capra; tale concentrazione è associata ancora una volta alla percentuale di grasso inferiore rispetto alle altre specie. L’ipotesi di un maggiore contenuto di iodio nel latte a basso contenuto di grasso avanzata per il latte vaccino, potrebbe dunque essere confermata anche nelle altre specie di ruminanti. In generale, le differenze nelle concentrazioni di iodio tra le diverse specie sono probabilmente ascrivibili a dieta e fisiologia degli animali, sistemi di allevamento e procedure di mungitura, come riportato anche per i principali minerali del latte.
Tuttavia, i presenti risultati derivano da un numero limitato di campioni ed ulteriori analisi dovranno essere condotte per consolidare le ipotesi della variabilità di tale contenuto potendo fare affidamento su un protocollo rapido e attendibile per la quantificazione dello iodio nel latte.
Il protocollo proposto può essere utilizzato per la quantificazione affidabile di campioni di latte contenenti iodio in quantità superiori o uguali a 0,3 µg/kg, permettendo la valutazione della quantità di questo micronutriente nel latte vaccino commerciale e nel latte proveniente da altre specie di ruminanti in maniera rapida e semplice auspicando studi più approfonditi, con la possibilità di ulteriore valorizzazione del latte e dei suoi derivati come alimenti da introdurre nell’ambito di una sana e corretta alimentazione in quanto importanti fonti di iodio (Watutantrige Fernando, 2013).
Nei prossimi mesi, in seguito ad ulteriori campionamenti di latte proveniente da diverse razze bovine, saranno proposti dei modelli di predizione basati sulla tecnologia del medio infrarosso, ovvero la stessa utilizzata in routine nei laboratori latte-qualità per l’analisi del latte di massa aziendale e del latte proveniente dai controlli funzionali delle singole bovine.
L’obiettivo sarà quello di studiare la variazione dello iodio sia a livello aziendale individuando eventuali fonti di variabilità (ad esempio razionamento e stagione di mungitura), che a livello di singola bovina per meglio declinare alcuni aspetti fenotipici e genetici legati allo stesso.
Autori
Vania Vigolo, Giovanni Niero, Martino Cassandro, Massimo De Marchi
Dipartimento di Agronomia Animali Alimenti Risorse Naturali e Ambiente (DAFNAE)
Università degli Studi di Padova
vania.vigolo@studenti.unipd.it – 349 6981819
| DOI | 10.17432/RMT.2018-1022 |
Bibliografia
- EFSA, 2014. Scientific opinion on the dietary reference values for iodine. EFSA Journal 12:3660-3717.
- Franzoi, M., G. Niero, M. Penasa, M. Cassandro, and M. De Marchi. Technical note: Development and validation of a new method for the quantification of soluble and micellar calcium, magnesium, and potassium in milk. Journal of Dairy Science 101:1883-1888.
- Hedayati, M., A. Ordookhani, M. S. Daneshpour, and F. Azizi. 2007. Rapid acid digestion and simple microplate method for milk iodine determination. Journal of Clinical Laboratory Analysis 21:286-292.
- Legge 21 marzo 2005, n. 55. Disposizioni finalizzate alla prevenzione del gozzo endemico e di altre patologie da carenza iodica. Gazzetta Ufficiale n. 91 del 20 aprile 2005.
- Naozuka, J., M. A. M. S. da Veiga, P. V. Oliveira, and E. de Oliveira. Determination of chlorine, bromine and iodine in milk samples by ICP-OES. Journal of Analytical Atomic Spectrometry 18:917-921.
- Reid, H. J., A. A. Bashammakh, P. S. Goodall, M. R. Landon, C. O’Connor, and B. L. Sharp. 2008. Determination of iodine and molybdenum in milk quadrupole ICP-MS. Talanta 75:189-197.
- Underwood, E. J. 1977. Trace Elements in Human and Animal Nutrition. 4th ed. Academic Press, New York, NY.
- van der Reijden, O. L., V. Galetti, M. Hulmann, A. Krzystek, M. Haldimann, P. Schlegel, E. Manzocchi, J. Berard, M. Kreuzer, M. B. Zimmerman, and I. Herter-Aeberli. 2018. The main determinants of iodine in cows’ milk in Switzerland are farm type, season and teat dipping. British Journal of Nutrition 119:559-569.
- Watutantrige Fernando, S., S. Barollo, D. Nacamulli, D. Pozza, M. Giachetti, F. Frigato, M. Redaelli, G. Zagotto, M. E. Girelli, F. Mantero, and C. Mian. 2013. Iodine status in schoolchildren living in northeast Italy: the importance of iodized-salt use and milk consumption. European Journal of Clinical Nutrition 67:366-370.
- Zimmermann, M. B., and M. Andersson. 2011. Prevalence of iodine deficiency in Europe in 2010. Annales d’Endocrinologie 72:164-166.
- WHO/FAO. 2004. Vitamin and mineral requirements in human nutrition: report of a joint FAO/WHO expert consultation, Bangkok, Thailand, 21–30 September 1998. pp. 311.