Proprietà Bioattive delle Proteine del Latte con Particolare Attenzione all’ Anti Cariogenicità
William R. Aimutis
Food Technical Development Center, Cargill, Inc., Wayzata, MN 55391
ABSTRACT
Al di là dell’ aspetto nutritivo, ci sono un gran numero di dati e di informazioni che dimostrano il ruolo bioattivo, negli adulti, delle componenti contenute nei latticini, incluso il ruolo preventivo nei confronti delle carie dentali. Più specificatamente, la frazione della caseina e gli idrolizzati sono stati il punto focale dei ricercatori che investigavano sulla prevenzione della cariogenesi. Lo smalto dei denti è una sostanza polimerica costituita da cristalli di fosfato di calcio incorporati in una matrice proteica. Le carie dentali si sviluppano in seguito ad una demineralizzazione acida (solubilizzazione di calcio e fosforo) dello smalto dentale. La demineralizzazione può avvenire direttamente (consumo di cibi acidi) o indirettamente (a causa dei prodotti di fermentazione di batteri odontopatogeni che crescono sui residui di particelle di cibo deposte tra i denti o che aderiscono alla placca). Gli obiettivi della ricerca sui peptidi bioattivi contenuti nei prodotti derivati dal latte, si sono concentrati sull’ inibizione della cariogenesi, sui batteri che si formano sulla placca, sull’inibizione della demineralizzazione dello smalto dei denti e sulla sua successiva rimineralizzazione. Il Caseinofosfopeptide (CPP) e il Glicomacropeptide (GMP) sono stati brevettati come componenti d’uso nei comuni prodotti per l’igiene dentale allo scopo di prevenire le carie dentali. Le ricerche hanno mostrato che CPP e GMP sono degli inibitori della crescita nei confronti del batterio cariogeno Streptococcus Mutans e anche di altre specie. Inoltre, il CPP forma dei nanocluster con il fosfato di calcio amorfo (AMP) sulla superficie del dente con lo scopo di formare un serbatoio di ioni calcio e fosfato e mantenere uno stato di saturazione eccellente rispetto allo smalto dei denti. Ciò tamponerebbe il pH della placca, e fornirebbe anche ioni per la rimineralizzazione dello smalto dei denti. Le strutture glicosidiche legate al GMP sono importanti per le numerose proprietà bioattive del peptide tra cui l’anti-cariogenicità. Come il CPP, anche il GMP ha mostrato attività inibitoria nei confronti della demineralizzazione dello smalto e in più favorisce la rimineralizzazione dello smalto dei denti.
PAROLE CHIAVE: latte bioattivo, anticariogenicità, caseinofosfopeptide, glicomacropeptide
Le carie dentali sono uno dei più grandi problemi di salute pubblica che affliggono tutti i Paesi del Mondo. Le nazioni industrializzate hanno cercato di controllare il problema con l’aiuto dell’acqua arricchita con fluoruro e con prodotti per l’igiene personale a partire dagli inizi del 1960, ma la cariogenicità rimane un’emergenza che grava economicamente sul sistema sanitario in maniera maggiore rispetto a molte malattie più pubblicizzate, come le malattie cardiache, il cancro e l’ipertensione. Le malattie dentali sono un’epidemia silente che negli Stati Uniti, affligge i bambini e gli adulti (1). Come i Paesi sviluppati hanno iniziato a consumare cibi più complessi, le carie hanno iniziato ad essere un vero problema (2). L’alto rischio di sviluppare carie dentali è accentuato da una serie di variabili socio demografiche tra cui l’etnia e il basso livello socio-economico. Inoltre, alcuni individui sono a rischio poiché le carie possono comparire come complicazione di malattie già presenti tra cui il diabete (3,4), l’obesità (5) e l’osteoporosi (6). I ricercatori e gli sviluppatori di prodotti continuano a ricercare articoli in grado di ridurre la gravità e la prevalenza complessive delle carie dentali. Grande enfasi è stata posta sullo sviluppo di prodotti che sono convenienti per i consumatori come le gomme da masticare e i confetti senza zucchero, che offrono un certo grado di protezione nei confronti degli agenti che causano la carie.
Il latte è un eccellente cibo proteico in grado di fornire aminoacidi essenziali e azoto organico per gli esseri umani e gli animali di tutte le età. Il latte contiene anche delle sostanze che hanno proprietà anti-cariogene: calcio, fosforo, caseina e lipidi. I latticini sono stati riconosciuti, nel lontano 1950, come un gruppo di alimenti che agisce nel prevenire le carie dentali. Shaw e al. (7) hanno osservato che il latte, il gelato e il formaggio abbassano l’incidenza delle carie nei ratti. Studi epidemiologici fatti negli ultimi anni hanno indicato che i bambini (8) e gli adolescenti (9) con una bassa incidenza di carie dentali, bevono più latte rispetto a quelli con una più alta incidenza. Le persone più anziane che mangiano formaggio più volte alla settimana hanno un’incidenza minore di sviluppare carie superficiali della radice (10). Un gran numero di review descrive il ruolo del latte e dei latticini nella prevenzione delle carie dentali (11-13). Lo scopo di questo articolo è di rivedere il ruolo delle proteine secondarie del latte e dei peptidi bioattivi inseriti nelle principali proteine del latte che inibiscono la cariogenesi.
Patogenesi della carie dentale
I denti dei bambini cominciano ad infettarsi, con batteri potenzialmente odontopatogeni, tra la metà del secondo e la fine del terzo anno di vita, periodo che viene detto “finestra dell’infettività” (14). La fonte primaria d’infezione nei bambini è di origine materna, ma sicuramente anche le condizioni ambientali, come l’essere nati in una popolazione incline allo sviluppo di carie, può favorire le infezioni non familiari (15). I bambini che non vengono infettati da alte dosi materne di batteri entro il terzo anno di età rimangono minimamente colonizzati da questi stessi batteri odontopatogeni fino all’eruzione della dentizione secondaria. Le lesioni cariose, o lo scadimento della dentatura in generale, sono la manifestazione clinica di un processo patogenetico che si può verificare in seguito ad una serie di interazioni avvenute sulla superficie dei denti per mesi o anni. La placca è un biofilm presente sulla superficie dello smalto dentale, composta da batteri vitali e non, mucopolisaccaridi, altri detriti e metaboliti. Il primo step della cariogenesi è che i batteri della normale flora orale iniziano a decomporsi in seguito all’interazione con i componenti della dieta (ad esempio il saccarosio) sulla superficie dello smalto dentale. La placca dentale che appare sulla superficie dello smalto è il primo segno clinico evidente di questa interazione. I batteri della placca metabolizzano gli zuccheri della dieta per produrre acidi organici che solubilizzano lo smalto dei denti composto da cristalli di idrossiapatite di fosfato calcio. Quando lo smalto è esposto agli acidi organici, il calcio fosfato viene solubilizzato a calcio libero che viene poi rimosso dai movimenti della saliva nella bocca. Questo processo è chiamato demineralizzazione ma può essere invertito dalla presenza di bicarbonato di sodio nella saliva che aiuta nella rimineralizzazione.
Il ruolo dei batteri nel causare la carie dentale è fonte di controversie continue; è stato infatti preso in considerazione se la responsabilità sia da attribuire ad una specifica specie batterica o a una flora batterica mista aspecifica. Inoltre si è discusso molto anche sul fatto se la carie fosse un’infezione batterica nel senso classico del termine o una sovracrescita eccessiva (16). La presenza frequente di Lactobacillus Acidophilus e di Streptococcus Mutans in corso di carie ci fa pensare che possano essere considerati dei cariogeni veri e propri. Comunque molti altri batteri, normalmente presenti nel cavo orale, sono capaci di produrre un aumento sostanziale di acido organico proveniente dalla fermentazione dei carboidrati e questo fornisce prove di una certa aspecificità. Molteplici studi hanno dimostrato che alcuni batteri indigeni sono capaci di rimineralizzare lo smalto dentale e di prevenire la carie dentale. Ad oggi, è necessaria un’ulteriore ricerca per comprendere l’ecologia dei batteri e il loro metabolismo per poter sviluppare strategie terapeutiche per contrastare l’accumulo di acido in eccesso e la demineralizzazione del dente. La carie dentale è ancora la causa predominante di perdita dei denti nella popolazione di tutto il Mondo. Numerosi approcci sono stati usati per proteggere i bambini e gli adulti dalle carie. È stato visto che il latte e i latticini hanno dei fattori cariostatici. Comunque i fattori cariostatici che derivano dal latte hanno un’efficacia limitata all’interno della loro fonte perché necessitano di un consumo molto elevato di latte stesso. I ricercatori si sono concentrati sull’isolamento dal latte dei fattori protettivi per poterli usare come additivi negli alimenti o nei prodotti per l’igiene personale allo scopo di ridurre la cariogenesi.
Proteine del latte
Il latte è sintetizzato dalle cellule epiteliali mammarie secretorie e contiene 2 grandi gruppi di proteine che si distinguono per la loro solubilità nel latte non riscaldato a pH 4,6 e 20 ° C: caseine (insolubili) e proteine del siero di latte (solubili). Entrambi i gruppi hanno proprietà fisico-chimiche e biologiche uniche . Le caseine sono circa l’80% delle proteine totali del latte bovino e si ritrovano principalmente come complessi micellari con fosfato di calcio stabilizzato. Le caseine sono una famiglia eterogenea di proteine costituita principalmente da αs1 , αs2, β e κ- caseine (17). Le proteine individuali della caseina sono delle molecole piccole con massa molecolare compresa tra 20-25 kDa, e sequenze aminoacidiche primarie ricche di prolina. La prolina previene la formazione di strutture secondarie nella molecola di caseina (α-elica, foglietti β). Tutte le caseine mostrano un polimorfismo genetico e hanno modificazioni post-traduzionali sia con frazioni di fosforo e/o di carboidrati. Le caseine sono relativamente idrofobiche e hanno dei cluster di sequenze primarie con un’alta idrofobicità di superficie che contribuiscono ad alcune proprietà funzionali come l’emulsionabilità e la schiumosità. Fox (18) e Wong e al. (19) hanno rivisto la relazione tra la struttura e la funzione individuale della caseina. Le proteine del siero (28% del totale delle proteine) sono anch’esse un gruppo di proteine eterogeneo e polimorfico composto da α-lattalbumina (α-LA, 20%), β-Lattoglobulina (β-Lg, 50%), albumina sierica (BSA, 10%), immunoglobuline (10%) e proteoso peptoni (˂10%). Diversamente dalle caseine, le proteine del siero presentano un livello elevato di strutture secondarie, terziarie e quaternarie e sono delle strutture globulari molto labili al calore. Tutte queste proteine hanno dei legami disolfuro che stabilizzano la loro struttura, per lo più non sono glicosilate e nessuna è fosforilata. Le proteine principali (α-LA e β-Lg) sono responsabili di proprietà funzionali, quali proprietà schiumogene e di gelificazione, e sono state commercializzate nel concentrato di proteine del siero di latte e in altri prodotti. Il latte contiene numerose proteine minori che si ritrovano principalmente nelle frazioni del siero e nelle membrane dei globuli di grasso. Queste tipologie di proteine minori non hanno proprietà funzionali significative come le caseine e le proteine del siero, ma alcune sembrano avere degli effetti fisiologici. Le proteine minori comprendono enzimi, proteine leganti i metalli, enzimi inibitori, proteine leganti le vitamine e molti fattori di crescita (18). Alcune proteine minori dei latticini sono state incluse come ingredienti bioattivi nei prodotti nutraceutici.
Bioattività delle proteine del latte
Proteine e peptidi bioattivi sono incorporati nelle sequenze primarie delle caseine e delle proteine del siero di latte. Le sequenze bioattive che derivano dal latte esercitano una serie di attività regolatorie. Le attività biologiche identificate comprendono modulazione delle funzioni gastrointestinali, emodinamica (ipertensione e flusso ematico gastrico), anti-cariogenicità, proprietà analgesiche, fattori di crescita, immunoregolazione e difesa dalle malattie non immunitarie. La maggior parte delle bioattività sono espresse solo dai peptidi derivati dalla sequenza di amminoacidi delle proteine originarie del latte. Le proteasi digestive, o la proteolisi in vitro, liberano i peptidi bioattivi a beneficio dell’ospite. I peptidi derivati dal latte sono ora prodotti per il commercio e vengono utilizzati come integrazioni alimentari in alimenti funzionali e in prodotti per uso personale. Tuttavia, pochissimi studi clinici sono stati condotti per dimostrare la sicurezza dei peptidi derivati dal latte. La maggior parte delle aziende commerciali ha presunto un certo grado di sicurezza sulla base dell’utilizzo di materie prime considerate “sicure”. Studi nutrizionali, sulla tossicità acuta, e sull’allergenicità non sono stati ancora adeguatamente condotti (20). Sono state scritte estese review sulla bioattività che deriva dal latte (21,22). La lattoferrina è una proteina in grado di legare il ferro che si riscontra nel latte di molte specie tra cui il bovino e l’uomo e si è visto che possiede molteplici proprietà bioattive. Il ruolo bioattivo della lattoferrina sembra essere dipendente dall’eccezionale capacità di legare il ferro. La disponibilità del ferro, proveniente da un latte artificiale con supplemento di lattoferrina bovina, è stata valutata mediante studi bilanciati sul ferro nei neonati (23). La ritenzione del ferro era del 36% nel gruppo che assumeva il supplemento contro il 28% di quello che non lo assumeva. È stato anche dimostrato che la lattoferrina ha un effetto stimolante sulla crescita delle cellule poiché va a stimolare la sintesi del DNA (24, 25). Altri ricercatori hanno riportato che inibisce la proliferazione delle linee cellulari cancerose in vitro (26, 27). Inoltre la lattoferrina ha attività antibatterica nei confronti dei Gram negativi tra cui il cariogeno dentale Streptococcus mutans (28). La lattoferrina è una proteina “moonlighting” che presenta molteplici funzioni espresse in situazioni diverse e in tempi diversi, come ampiamente esaminato da Shimazaki (29). Anche altre proteine minori presenti nel latte bovino hanno attività antibatterica. Il lisozima è un efficace antibatterico isolato dal latte, dalle lacrime e dalla saliva. Il latte umano è la fonte migliore di lisozima ( 2.5 mg/100 mL) rispetto al latte bovino ( 0.025 mg/100 mL). Il meccanismo d’azione del lisozima è quello di idrolizzare i legami β (1→4)glicosidici del peptidoglicano nella parete della cellula batterica. La lattoperossidasi è una perossidasi che contiene porfirina ed è secreta dalle ghiandole mammarie. Questo enzima è parte di un complesso che ha anche effetti antibatterici; essa catalizza l’ossidazione del tiocianato (SCN¯ ) ad ipotiocianato usando il perossido d’idrogeno prodotto dai batteri endogeni ( Fig.1). I componenti bioattivi indotti vengono definiti come “attività derivate” da meccanismi proteolitici o immunologici (30). La modificazione proteica causata dalle proteasi può verificarsi in situ nella ghiandola mammaria o nel tratto digerente oppure con la digestione in vitro con l’utilizzo di proteasi sintetiche. I peptidi risultanti possono influenzare particolari processi fisiologici o metabolici. I componenti bioattivi di derivazione immunologica sono il risultato della vaccinazione delle bovine per indurre la produzione di anticorpi nei confronti di antigeni vaccinali. La κ-caseina bovina trattata con chimosina è clivata in 2 peptidi durante la caseificazione. La para κ-caseina (residui 1→105) rimane nella cagliata mentre un peptide unico, il glicomacropeptide, ( residui 104→109) viene eluito con il siero prodotto per fare il formaggio (17). Il Glicomacropeptide (GMP) è il principale componente delle proteine del siero del formaggio essendo il 15-20% delle proteine totali, inoltre è un glicofosfopeptide che non contiene aminoacidi aromatici. Ciò potrebbe avere implicazioni positive per alcune popolazioni con ristrettezze alimentari. Le strutture glicosidiche (Tabella 1) attaccate al peptide sono importanti per la bioattività del GMP. In presenza di GMP è stata riportata la capacità di legare le enterotossine di Vibrio cholerae e di Escherichia coli (31). I carboidrati legati al GMP mimano i siti recettoriali per le enterotossine. In studi effettuati sugli animali, i quali venivano infettati sperimentalmente, si è visto che il GMP lega l’enterotossina e il complesso viene eliminato dal tratto intestinale. Il GMP trattato con neuroamonidasi, per rimuovere l’acido sialico dai carboidrati della catena terminale della parte glicosidica, perde la sua bioattività. Durante esperimenti fatti in vivo, nutrendo i ratti con il GMP (1 mg/die) si è visto che risultavano protetti dalle enterotossine prodotte da V. cholerae ed E. coli e dalla conseguente diarrea (32). Kawasaki e al. (33) hanno dimostrato che il GMP è in grado di inibire l’emoagglutinazione dovuta a 4 ceppi di virus influenzale umano e l’effetto è stato riscontrato anche a basse concentrazioni di GMP (80 mg/L). L’emoagglutinazione dovuta a Mycoplasma gallisepticum (34) e a M. pneumoniae non è invece inibita dal GMP. Il ruolo del GMP come prebiotico non è ancora chiaro. I prebiotici sono un insieme di composti che promuovono la crescita di batteri intestinali favorevoli (probiotici).
Figura 1 meccanismo d’azione della lattoperossidasi. Tiocianato (SCN-) e ipotiocianato (OSCN-)
H2O2 + SCN–→ OSCN– + H2O
o
2 SCN– + H2O2 +2 H+ →( SCN2) + 2 H2O → OSCN– + SCN– + 2 H+
TABELLA 1
Struttura glicosidica del glicomacropeptide
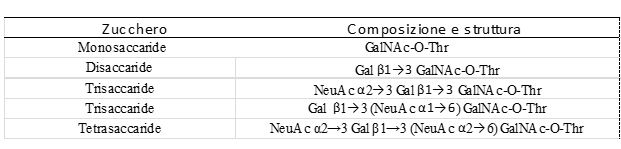
Galattosio (Gal), N-acetil galattosammina (GalNAc), acido neuramunico (NeuNAc), Treonina (Thr).
Kehagias e al. (36) hanno evidenziato che la crescita di bifidobatteri era favorita da una frazione della caseina molto simile al GMP. Poch e Bezkorovainy (37) hanno dimostrato che la digestione della caseina bovina e del siero favorisce la crescita dei bifidobatteri. Petchow e Talbott (38) hanno trovato che l’attività promovente la crescita di alcune specie di bifidobatteri è presente nel latte bovino ultrafiltrato, permeato e retentato (il GMP sarebbe presente nel latte retentato). Pertanto, sembra che il latte permeato possa contenere amminoacidi e altri composti necessari anche per la crescita di bifidobatteri.
Le micelle del latte contengono fisiologicamente un quantitativo importante di calcio e fosforo. Il fosforo nel latte forma dei legami mono-esterici con i residui di caseina-serina. Il calcio e fosforo legati alla caseina aiutano a mantenere termodinamicamente stabili le micelle di caseina nel latte fluido. I caseinofosfopeptidi (CPP) sono dei peptidi che derivano dalla caseina fosforilata prodotti dalla digestione di αs1-, αs2-, e β-caseina in vitro o in vivo nel tratto digerente (Tabella 2). La CPP complessa e solubilizza i minerali in particolar modo il calcio, per questo ne favorisce la biodisponibilità durante l’assorbimento nel tratto intestinale rendendo i minerali solubili e prevenendo la loro precipitazione. La maggior parte dei CPP contengono un cluster serina fosfato e residui glutamminici nella sequenza di 3 gruppi fosfoserilici seguiti da 2 residui di acido glutammico. Questi aminoacidi servono come siti di legame per i minerali avendo delle catene laterali con carica negativa. Tuttavia, vi è una differenza di attività per il legame del calcio a seconda della fonte di caseinofosfopeptide (39). L’ordine dell’abilità di chelare il calcio è: αs2-caseina > αs1-caseina > β-caseina > κ-caseina. I fosfopeptidi rilasciati dalle molecole di caseina sono resistenti ad ulteriori rotture proteolitiche nel tratto intestinale. La formazione di CCP nel tratto intestinale potrebbe aumentare la concentrazione del calcio solubile disponibile per l’animale ospite (40).
TABELLA 2 sequenze primarie del caseinofosfopeptide derivate da α-caseine e β-caseine

Comunque i dati riportati sono discordanti per quanto riguarda l’assorbimento e il bilancio del Ca e la formazione dell’osso. Benché il CPP sembri avere pochi effetti in animali giovani e sani (41-43), dati positivi sono stati osservati in ratti sottoposti a ovariectomia (44) e in donne in post menopausa (45). Altri studi hanno mostrato che l’assorbimento di Ca e Zn può essere favorito nei cuccioli di ratto (46) nutriti con formule a base di soia o avena oppure in individui in salute (47) alimentati con diete a base di riso o cereali integrali. La lattoferricina B è un peptide bioattivo contenuto all’interno della lattoferrina, e può essere liberata dalla pepsina presente negli enzimi digestivi (48). La lattoferricina è attiva sia contro Gram positivi che contro i Gram negativi ed è molto più battericida della lattoferrina indigerita perché le dimensioni più piccole del peptide possono facilitare l’accesso a siti suscettibili presenti sulla superficie batterica (49). Gli effetti della lattoferricina B nei confronti di batteri odontopatogeni non sono stati ancora indagati.
Attività anticariogena delle proteine bioattive de latte
I primi studi hanno riconosciuto che i prodotti lattiero-caseari (latte, caseina, caseinati e formaggi) hanno attività anti-cariogena (50,51). La caseina acida (insolubile) contenuta come principio attivo nel dentifricio era efficace nel ridurre la carie dentale, ma per svolgere la sua attività doveva essere presente in quantità elevate (52,53). Il caseinato di sodio, solubilizzato in acqua e dato come alimento ai ratti in modelli sperimentali, ha mostrato avere attività anti-cariogena (54). Il caseinato di sodio, se usato come ingrediente nella produzione di barrette di cioccolato riduce la cariogenesi, è però necessario ad alte dosi (17%) per provocare i suoi effetti e a queste dosi rende il prodotto poco appetibile (55,56). Pertanto, i primi studi hanno dimostrato che la caseina è una sostanza anti-cariogena efficace, ma le sue proprietà organolettiche avverse e la grande quantità necessaria per sviluppare la sua l’efficacia precludono il suo utilizzo come alimento o come dentifricio. In un modello di carie orale umana si è visto che la digestione con tripsina del caseinato non distrugge la capacità delle proteine di prevenire la demineralizzazione dello smalto (57). Le analisi fatte su campioni umani di placca dentale hanno trovato alte concentrazioni di peptidi di caseina, di calcio e di fosforo. Si è quindi concluso che questi peptidi fossero caseinofosfopeptidi che derivano dalla specifica attività triptica sulle αs1-, αs2-, e β-caseine. Ciò ha spinto i ricercatori a concentrarsi sui peptidi della caseina in successive ricerche. Molti dei componenti fisiologicamente attivi o bioattivi riportati rappresentano una frazione molto piccola dei costituenti totali del latte. Questo gruppo comprende lattoferrina, lisozima, lattoperossidasi, proteine che legano i folati, fattori di crescita e altre proteine (Tabella 3). Le immunoglobuline hanno un ruolo protettivo anche in vivo. I componenti bioattivi che hanno un ruolo nella prevenzione della carie dentale dovrebbero inibire meccanicamente batteri odontopatogenetici e/o legare i minerali. La prevenzione della carie dentale svolta dai peptidi bioattivi derivati dal latte è una complessa sequenza fisica e chimica di una cascata d’eventi. In generale, i peptidi bioattivi con attività anti cariogena hanno molteplici meccanismi per prevenire le lesioni dentali, tra cui l’inibizione batterica, l’esclusione competitiva sui siti di legame dello smalto, l’aumentare la funzione di scudo della pellicola che circonda i denti, la riduzione della demineralizzazione dello smalto e la rimineralizzazione dello smalto. Studi sull’anticariogenicità dei peptidi bioattivi del latte sono stati effettuati grazie ad un certo numero di modelli in vitro, in situ e in vivo. Gran parte del lavoro è stato fatto con caseinofosfopeptidi-fosfato di calcio colloidale amorfo(CPP-ACP). I caseinofosfopeptidi inibiscono lo sviluppo delle carie dentali influenzando il processo di demineralizzazione/rimineralizzazione dello smalto dentale. Una soluzione all’1% (wt:v) di CPP può stabilizare 60mmol/L CaCl2 e 36mmol/L di sodio fosfato a pH 7.0 per formare i complessi CPP/ACP (58). Degli specifici ratti pathogen-free infettati per via orale con Streptococcus sobrinus, avevano una ridotta incidenza di carie della superficie liscia dopo che soluzioni di CPP-ACP venivano applicate sui denti dell’animale due volte al giorno.
TABELLA 3 proteine bioattive secreta nel latte bovino
Una risposta dose-dipendente è stata osservata con uno 0,1% (wt: v) di CPP-ACP che ha prodotto una riduzione del 14% e con un 1,0% di CPP-ACP, che ha prodotto un 55% di riduzione rispetto a un controllo con acqua distillata. Questi risultati erano simili a quelli di un controllo con 50ppm di fluoro. Un effetto sinergico è stato segnalato quando CPP-ACP (0,5%) e fluoro (500ppm) sono stati applicati insieme sui denti di topo. I peptidi di caseina non fosforilata non hanno avuto effetti anti cariogeni. Un ottapeptide di sintesi, Ac-Glu-Ser(P)-Ile-Ser(P)-Ser (P)-Ser(P)-Glu-Glu-NHMe, ha ridotto significativamente la comparsa della carie nel modello di ratto. Questo ha confermato che le porzioni di CPP xn-Ser(P)-Ser(P)-Ser(P)-Glu-Glu-xn sono associate all’anticariogenicità. Comunque l’ottapeptide di sintesi non era così efficace nel legare l’ACP o nel meccanismo di anticariogenicità come il CPP-ACP. Questo indica che per avere una piena attività sono richiesti altri residui e/o specificità conformazionali come nei più lunghi αs1 – e β-peptidi. È stato usato un modello di carie umana in situ per studiare la capacità dell’1% di CPP-ACP di prevenire la demineralizzazione dello smalto (59). Gli esseri umani venivano dotati di un apparecchio dentale rimovibile che conteneva una coppia di lastre di smalto (una a destra e una sinistra) poste nella bocca per produrre un sito di ritenzione della placca. La frequente esposizione a soluzioni di saccarosio alzavano i livelli di streptococchi orali mutati e di lattobacilli. La demineralizzazione sotto la superficie dello smalto ha comportato una lesione iniziale molto simile ad una carie. Due esposizioni giornaliere alla soluzione di CPP-ACP ad un lato della lastra riduce (del 51% ± 19%) la perdita di minerali dello smalto rispetto al lato di controllo. La placca esposta al CPP-ACP ha 2.5 volte più Ca e fosforo rispetto al lato di controllo. Il caseinofosfopeptide stabilizza l’ACP e a sua volta, è usato per localizzare l’ACP nella placca dentale, in più rappresenta un deposito di calcio di grandi dimensioni all’interno della placca e rallenta la diffusione del calcio libero (60). È probabile che si verifichi la perdita limitata di minerali durante un episodio cariogeno, e ciò rappresenta anche una fonte di calcio per la remineralizzazione. Pertanto, il meccanismo di anti cariogenesi del CPP-ACP è che questo peptide bioattivo aumenta notevolmente il livello di fosfato di calcio amorfo nella placca deprimendo la demineralizzazione dello smalto e migliorando la rimineralizzazione. Come aumenta la concentrazione di CPP-ACP in contatto con i denti si ha remineralizzazione (Fig.2).
FIGURA 2 Dose-risposta del CPP sulla remineralizzazione della superficie dello smalto dentale (61)
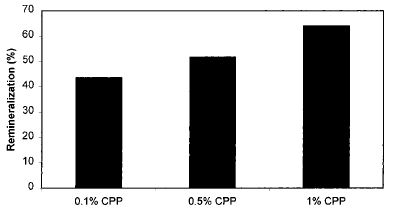
Un aumento della concentrazione del calcio libero o legato tra lo 0.5 e l’1.0% nelle preparazioni di CPP-ACP è più efficace nel favorire la remineralizzazione (61). Il caseinato di sodio, il CPP e il GMP inibiscono l’adesione dei batteri orali ai cristalli di idrossiapatite ricoperti di saliva (S-HA) (62). I potenziali patogeni dentali, come Streptococcus sobrinus OMZ 176 e Streptococcus Sangius OMZ 9, sono stati esclusi competitivamente dai cristalli di S-Ha grazie ai derivati della caseina. Tuttavia, Actinomyces viscosus Ny1 non è stato escluso dai cristalli di S-HA. Un altro esperimento su questo studio ha dimostrato che il caseinato, il CPP e il GMP erano in grado di legarsi direttamente alle pareti cellulari batteriche dei ceppi esaminati. Questi risultati offrono un altro possibile meccanismo di anticariogenicità legato ai bioattivi che derivano dai latticini. Inibendo selettivamente l’adesione streptococcica ai denti, le componenti bioattive del latte potrebbero modulare la composizione microbica della placca dentale e favorire la proliferazione di specie meno cariogene come gli actinomiceti orali (62). Ciò potrebbe anche controllare la formazione di acido nella placca dentale e a sua volta, ridurre la dissoluzione dei cristalli di idrossiapatite dello smalto dei denti (63). I componenti del latte CPP e GMP sono incorporati nella pellicola salivare, e riducono l’adesione di S. sobrinus e S. mutans (64). La microscopia elettronica ha visualizzato il GMP sulla superficie della pellicola in una forma globulare-micellare. Viceversa, il CPP è stato trovato sotto forma di strutture microglobulari e geometricamente irregolari. Questa inibizione relativamente selettiva nei confronti di S. mutans potrebbe alla fine produrre una placca non cariogena. Ulteriori prove sono state individuate da Rose (60) che indica che il CPP-ACP sarebbe in competizione con il calcio per i siti leganti il calcio presenti sulla placca. Ciò consentirà di ridurre la quantità di calcio che fa da ponte tra la pellicola e le cellule aderenti e tra le cellule stesse. Potrebbe essere che le alte concentrazioni di calcio libero extracellulare possano avere effetti batteriostatici o battericidi sui batteri odontopatogeni (65). Schupbach et al. (64) hanno dimostrato che il GMP potrebbe impedire l’adesione di batteri cariogeni in un modello in vitro. I ricercatori ipotizzano che il GMP riduce la carie andando a modificare la popolazione microbica della placca dentale passando da una costituita in prevalenza da Streptococcus mutans e S. Sangius, ad una popolazione con meno batteri cariogeni predominata da Actinomyces viscoso. Le proteine del siero che derivano dalla produzione di ricotta o precipitazione acida della caseina non erano così efficaci come il CPP nel prevenire la solubilizzazione del fosfato e del Ca dall’idrossiapatite (66). Anche se le proteine del siero non possono impedire la demineralizzazione dello smalto, è stato suggerito che il siero può esercitare un effetto anti cariogeno agendo come un tampone (54). Le proteine minori del siero possono avere un effetto anti cariogeno quando sono arricchite o purificate dalla miscela eterogenea di proteine del siero stesso. Ad esempio, la lattoperossidasi e il lisozima limitano il metabolismo di S. mutans (67). La lattoferrina inibisce l’adesione di S. mutans ai cristalli di idrossiapatite ricoperti di saliva (68). La lattoperossidasi e il lisozima collaborano sinergicamente per inibire il metabolismo del glucosio dovuto allo S. mutans, riducendo in tal modo la produzione di acido nell’ambiente della placca (69). È stato mostrato che le frazioni proteoso-peptone 3 e 5 sono in grado di inibire, in vitro, la demineralizzazione dell’idrossiapatite (70). Entrambe le frazioni proteoso-peptone sono contenute all’interno della β-caseina e sono liberate dall’idrolisi della plasmina (71,72), che è una proteasi endogena di latte.
Commercializzazione dei bioattivi del latte
C’è grande interesse, dal punto di vista commerciale, nella produzione di peptidi bioattivi derivanti dai latticini al fine di utilizzarli in prodotti come dentifrici, gel, o collutori. Il GMP della caseina è stato brevettato come agente antimicrobico che agisce contro lo S. mutans (73,74). Gli sviluppatori di prodotti hanno incorporato il GMP all’interno di prodotti commerciali che sono stati poi protetti da brevetti (75). L’unicità di questo brevetto consiste nell’uso di gelatina idrolizzata come stabilizzante nelle composizioni. Un brevetto è stato rilasciato (76) per la composizione anticarie e multicomponente di un dentifricio e per il suo metodo di utilizzo poiché conteneva il GMP e il fluoruro in combinazione. Un altro brevetto (77) è stato rilasciato quando è stato scoperto che il GMP in combinazione con lo xilitolo, sarebbe in grado agire sinergicamente per produrre risultati a favore della rimineralizzazione dello smalto superiori, rispetto a quelli osservati con combinazioni di xilitolo e fluoro (Fig. 3). L’assegnazione di questo brevetto è stata supportata da risultati in vitro sulla rimineralizzazione dello smalto. Un brevetto è stato depositato (Warner-Lambert Company) per poter utilizzare il CPP nella composizione dei chewing gum per promuovere l’anticariogenicità. La lattoferrina e la lattoperossidasi sono state incluse nelle formule di alcuni dentifrici con lo scopo di essere battericide nei confronti dei batteri cariogeni. La glucosio ossidasi, presente in questi dentifrici, attiva il sistema della lattoperossidasi per produrre acido ipotiocianato e ioni tiocianato nell’ambiente del cavo orale allo scopo di inibire i batteri odontopatogeni (Fig.4).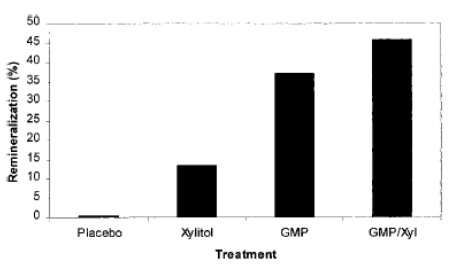
Figura 3 Effetti sinergici dei dentifrici contenenti glicomacropeptide e xilitolo sulla remineralizzazione dello smalto in situ. I soggetti adulti in salute venivano dotati di apparecchi per il palato costituiti da tavole di smalto dei denti demineralizzato. I soggetti lavavano i loro denti con dentifrici che contenevano come componenti attivi 10%-glicomacropeptide (GMP), 10% xilitolo (Xyl) 10%glicomacropeptide e 10% xilitolo (GMP/Xyl). Il dentifricio con placebo conteneva silice abrasiva senza fluoro. Lo spessore dell’idrossiapatite era determinato con le radiografie.
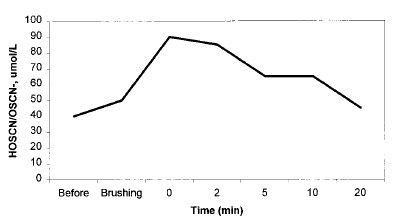
Figura 4 Efficacia dello spazzolamento (per un minuto) con un dentifricio commerciale contenente glucosio ossidasi (10,000 U), lattoperossidasi (15,000 U) e lisozima (16 mg) come componenti attivi, su composizione e su decomposizione dell’acido ipotiocianoso (HOSCN) e sullo ione tiocianato (OSCN–) (69)
Ricerche future
La carie dentale è un insieme di interazioni che hanno luogo sulla superficie del dente, e rimane un problema critico per la salute nonostante i passi avanti fatti nella fluorizzazione dell’acqua e dei dentifrici. I dati della ricerca, usando metodiche in situ, descritti in questo documento sono un valido argomento per quanto riguarda il fatto che i peptidi bioattivi, che derivano dai latticini, riducono la carie negli esseri umani. Tuttavia, il lavoro futuro sulla prevenzione della carie, dovrebbe essere incentrato su prove in vivo e sugli effetti epidemiologici del consumo dei bioattivi volti a ridurre o eliminare la carie dentale e non su ambienti artificiali di sviluppo della placca. Almeno in minima parte, dovrebbe essere osservato un effetto nel ridurre la gravità della carie. Finora i prodotti sviluppati con CPP (ad esempio gomme da masticare e dentifrici) hanno consentito ai peptidi di rimanere in contatto prolungato con l’ambiente della placca per prevenire la carie dentale. Il meccanismo d’azione primario comprende una riduzione della demineralizzazione dello smalto e una sua migliore rimineralizzazione.
BIBLIOGRAFIA
- U.S. Department of Health and Human Services (2000) Oral health in America: a report of the Surgeon General. NIH, Washington, DC.
- Liljemark, W. F. & Bloomquist, C. (1996) Human oral microbial ecology and dental caries and periodontal diseases. Crit. Rev. Oral Biol. Med. 7: 180–198.
- Sandberg, G. E., Sundberg, H. E., Fjellstrom, C. A. & Wikblad, K. F. (2000) Type 2 diabetes and oral health. A comparison between diabetic and non-diabetic subjects. Diabet. Res. Clin. Prac. 50: 27–34.
- Twetman, S., Johansson, I., Birkhead, D. & Nederfors, T. (2002) Caries incidence in young type I diabetes mellitus patients in relation to metabolic control and caries-associated risk factors. Caries Res. 36: 31–35.
- Ritchie, C. S. & Kinane, D. F. (2003) Nutrition, inflammation, and periodontal disease. Nutrition 19: 475–476.
- Norlen, P., Steen, B., Birkhead, D. & Bjorn, A. L. (1993) On the relations between dietary habits, nutrients, and oral health in women at the age of retirement. Acta Odontol. Scand. 51: 277–284.
- Shaw, J. H., Ensfield, B. J. & Wollman, D. H. (1959) Studies on the relationship of dairy products to dental caries in caries-susceptible rats. J. Nutr. 67: 253–273.
- Petti, S., Simonetti, R. & D’Arca Simonetti, A. (1997) The effect of milk and sucrose consumption on caries in 6- to11-year-old Italian school children. Eur. J. Epidemiol. 13: 659–664.
- Petridou, E., Athanassouli, T., Panagopoulos, H. & Revinthi, K. (1996) Sociodemographic and dietary factors in relation to dental health among Greek adolescents. Community Dent. Oral Epidemiol. 24: 307–311.
- Papas, A. S., Joshi, A., Belanger, A. J., Kent, R. L., Palmer, C. A. & DePaola, P. F. (1995) Dietary models for root caries. Am. J. Clin. Nutr. 61: 417S–422S.
- Moynihan, P. (2000) Foods and factors that protect against dental caries. Nutr. Bull. 25: 281–286.
- Kashket, S. & DePaola, D. P. (2002) Cheese consumption and the development and progression of dental caries. Nutr. Rev. 60: 97–103.
- Johansson, I. (2002) Milk and dairy products: possible effects on dental health. Scan. J. Nutr. 46: 119–122.
- Caufield, P. W., Cutter, G. R. & Dasanayake, A. P. (1993) Initial acquisition of mutans streptococci by infants: evidence for a discrete window of infectivity. J. Dent. Res. 72: 37–45.
- Mattos-Graner, R. O., Li, Y., Caufield, P. W., Duncan, M. & Smith, D. J. (2001) Genotypic diversity of mutans streptococci in Brazilian nursery children suggests horizontal transmission. J. Clin. Microbiol. 39: 2313–2316.
- Kleinberg, I. (2002) A mixed-bacteria ecological approach to understanding the role of the oral bacteria in dental caries causation: An alternative to Streptococcus mutans and the specific-plaque hypothesis. Crit. Rev. Oral Biol. Med. 13: 108–125.
- Eigel, W. N., Butler, J. E., Ermstrom, C. A., Farrell, H. M., Harwalker, V. R., Jenness, R. & Whitney, R. McL. (1984) Nomenclature of proteins of cow’s milk: fifth revision. J. Dairy Sci. 67: 1599–1631.
- Fox, P. F. (2001) Milk proteins as food ingredients. Int. J. Dairy Technol. 54: 41–55.
- Wong, D.W.S., Camirand, W. M. & Pavlath, A. E. (1996) Structures and functionalities of milk proteins. Crit. Rev. Food Sci. Nutr. 36: 807–844.
- Aimutis, W. R. (2002) Safety aspects related to milk-derived bioactives. Bull. Int. Dairy Fed. 375: 130–135.
- Shah, N. P. (2000) Effects of milk-derived bioactivities: an overview. Br. J. Nutr. 84: S3–S10.
- Steijns, J. M. (2001) Milk ingredients as nutraceuticals. Int. J. Dairy Technol. 54: 81–88.
- Schulz-Lell, G., Dorner, K., Oldigs, H.-D., Sievers, E. & Schaub, J. (1991) Iron availability from an infant formula supplemented with bovine lactoferrin. Act. Paediatr. Scand. 80: 155–158.
- Azuma, N., Mori, H., Kaminogawa, S. & Yamauchi, K. (1989) Stimulating effect of lactoferrin on DNA synthesis in BALB/c3T3 cell. Agric. Biol. Chem. 53: 31–35.
- Oria, R., Ismail, M., Sanchez, L., Calvo, M., & Brock, J. H. (1993) Effect of heat treatment and other milk proteins on the interaction of lactoferrin with monocytes. J. Dairy Res. 60: 363–369.
- Rejman, J. J., Oliver, S. P., Muenchen, R. A. & Turner, J. D. (1992) Proliferation of the MAC-T bovine mammary epithelial cell line in the presence of mammary secretion whey proteins. Cell Biol. Int. Rep. 16: 993–1001.
- Bezault, J., Bhimani, R., Wiprovnick, J. & Furmanski, P. (1994) Human lactoferrin inhibits growth of solid tumors and development of experimental metastases in mice. Cancer Res. 54: 2310–2312.
- Arnold, R. R., Brewer, M. & Gauthier, J. J. (1980) Bactericidal activity of human lactoferrin: sensitivity of a variety of microorganisms. Infect. Immun. 28: 893–898.
- Shimazaki, K. (2000) Lactoferrin: a marvelous protein in milk? Anim. Sci. J. 71: 329–347.
- Regester, G. O., Smithers, G. W., Mitchell, I. R., McIntosh, G. H. & Dionysius, D. A. (1997) Bioactive factors in milk: Natural and induced. In: Milk Composition, Production and Biotechnology (Welch, R.A.S., Burns, D.J.W., Davis, S. R., Popay, A. I. and Prosseer, C. G., eds.), pps. 119–132. CAB International Publishing, London.
- Isoda, H., Kawasaki, Y., Tanimoto, M., Dosako, S. & Idota, T. (1999) Use of compounds containing or binding sialic acid to neutralize bacterial toxins. European Patent 385,118.
- Kawasaki, Y., Isoda, H., Tanimoto, M., Dosako, S., Idota, T. & Ahiko, K. (1992) Inhibition by lactoferrin and #-casein glycomacropeptide of binding of cholera toxin to its receptor. Biosci. Biotech. Biochem. 56: 195–198.
- Kawasaki, Y., Isoda, K., Shinmoto, H., Tanimoto, M., Dosako, S., Idota, T. & Nakajima, I. (1993) Inhibition by #-casein glycomacropeptide and lactoferrin of influenza virus hemagglutination. Biosci. Biotech. Biochem. 57: 1214–1215.
- Glasgow, L. R. & Hill, R. L. (1980) Interaction of Mycoplasma gallisepticum with sialyl glycoproteins. Infect. Immun. 30: 353–361.
- Loomes, L. M., Uemura, K., Childs, R. A., Paulson, J. C., Rogers, G. N., Scudder, P. R., Michlaski, J-C., Housell, E. F., Taylor-Robinson, D. & Feizi, T. (1984) Erythrocyte receptors for Mycoplasma pneumoniae are sialylated oligosaccharides of li antigen type. Nature 307: 560–563.
- Kehagias, C., Jao, Y. C., Micolajcik, E. M. & Hansen, P.M.T. (1977) Growth response of Bifidobacterium bifidum to a hydrolytic product isolated from bovine casein. J. Food Sci. 42: 146–150.
- Poch, M. & Bezkorovainy, A. (1991) Bovine milk #-casein trypsin digest is a growth enhancer for the genus Bifidobacterium. J. Agric. Food Chem. 39: 73–77.
- Petschow, B. W. & Talbott, R. D. (1991) Response of Bifidobacterium species to growth promoters in human and cow milk. Pediatr. Res. 29: 208–213.
- Schlimme, E. & Meisel, H. (1995) Bioactive peptides derived from milk proteins. Structural, physiological and analytical aspects. Nahrung Food 39: 1–20.
- Lee, Y. S., Noguchi, T. & Naito, H. (1980) Phosphopeptides and soluble calcium in the small intestine of rats given a casein diet. Br. J. Nutr. 43: 457–467.
- Brommage, R., Juillerat, M. A. & Jost, R. (1991) Influence of casein phosphopeptides and lactulose on intestinal calcium absorption in adult female rats. Lait 71: 173–180.
- Pointillart, A. & Gueguen, L. (1989) Effect of calcium phosphopeptides on calcium and phosphorus utilization in growing pigs. Reprod. Nutr. Dev. 29: 477–486.
- Scholz-Ahrens, K. E., Kopra, N. & Barth, C. A. (1990) Effect of calcium phosphopeptides on utilization of calcium in minipigs and vitamin D deficient rats. Z. Ernahrungswiss. 29: 295–298.
- Tsuchita, H., Goto, T., Shimizu, T., Yonehara, Y. & Kuwata, T. (1996) Dietary phosphopeptides prevent bone loss in aged ovariectomized rats. J. Nutr. 126: 86–93.
- Heany, R. P., Saito, Y. & Orimo, H. (1994) Effect of casein phosphopeptide on absorbability of co-ingested calcium in normal postmenopausal women. J. Bone Min. Metab. 12: 77–81.
- Hansen, M., Sandstrom, B. & Lonnerdal, B. (1996) The effect of casein phosphopeptides on zinc and calcium absorption from high phytate infant diets assessed in rat pups and Caco-2 cells. Pediatric. Res. 40: 547–552.
- Hansen, M., Sandstrom, B., Jensen, M. & Sorensen, S. S. (1997) Casein phosphopeptides improve zinc and calcium absorption from rice-based but not from whole-grain infant cereal. J. Ped. Gastroent. Nutri. 24: 56–62.
- Jones, E. M., Smart, A., Bloomberg, G., Burgess, L. & Millar, M. R. (1994) Lactoferricin, a new antimicrobial peptide. J. Appl. Bacteriol. 77: 208– 214.
- Tomita, M., Bellamy, W. R., Takase, M., Yamauchi, K., Wakabayashi, H. & Kawase, K. (1991) Potent antibacterial peptides generated by pepsin digestion of bovine lactoferrin. J. Dairy Sci. 74: 4137–4142.
- Schweigert, B. S., Shaw, J. H., Zepplin, M. & Elvehjem, C. A. (1946a) Dental caries in the cotton rat. VI. The effect of the amount of protein, fat, and carbohydrate in the diet on the incidence and extent of carious lesions. J. Nutr. 31: 439–447.
- Shaw, J. H. (1950) Effects of dietary composition on tooth decay in the albino rat. J. Nutr. 41: 13–23.
- Schweigert, B. S., Potts, E., Shaw, J. H., Zepplin, M. & Phillips, P. H. (1946b) Dental caries in the cotton rat. VIII. Further studies on the dietary effects of carbohydrate, protein, and fat on the incidence and extent of carious lesions. J. Nutr. 32: 405–412.
- Bavetta, L. A. & McClure, F. J. (1957) Protein factors and experimental rat caries. J. Nutr. 63: 107–117.
- Reynolds, E. C. & del Rio, A. (1984) Effect of casein and whey protein solutions on the caries experience and feeding patterns of the rat. Arch. Oral Biol. 29: 927–933.
- Reynolds, E. C. & Black, C. L. (1987) Reduction of chocolate’s cariogenicity by supplementation with sodium caseinate. Caries Res. 21: 445–451.
- Reynolds, E. C. & Black, C. L. (1989) Cariogenicity of a confection supplemented with sodium caseinate at a palatable level. Caries Res. 32: 368– 370.
- Reynolds, E. C. (1987) The prevention of subsurface demineralization of bovine enamel and change in plaque composition by casein in an intra-oral model. J. Dent. Res. 66: 1120–1127.
- Reynolds, E. C. (1995) Dairy products and dental health. Proc. Nutr. Soc. Aust. 19: 95–102.
- Reynolds, E. C. (1991) Anticariogenic phosphopeptides. U.S. Patent 5,015,628.
- Rose, R. K. (2000) Binding characteristics of Streptococcus mutans for calcium and casein phosphopeptide. Caries Res. 34: 427–431.
- Reynolds, E. C. (1997) Remineralization of enamel subsurface lesions by casein phosphopeptide-stabilized calcium phosphate solutions. J. Dent. Res. 76: 1587–1595.
- Neeser, J. R., Golliard, M., Woltz, A., Dillmann, M. & Guggenheim, B. (1994) In vitro modulation of oral bacterial adhesion to saliva-coated hydroxyapatite beads by milk casein derivatives. Oral Microbiol. Immunol. 9: 193–201.
- Reynolds, E. C., Riley, P. F. & Storey, E. (1982) Phosphoprotein inhibition of hydroxyapatite dissolution. Calcified Tissues Intl. 34: 552–556.
- Schupbach, P., Neeser, J-R., Golliard, M., Rouvet, M. & Guggenheim, B. (1996) Incorporation of caseinoglycomacropeptide and caseinophosphopeptide into the salivary pellicle inhibits adherence of Streptococcus mutans. J. Dent. Res. 75: 1779–1788.
- Kobayashi, H., van Brunt, J. & Harold, F. M. (1978) ATP-linked calcium transport in cells and membrane vesicles of Streptococcus faecalis. J. Biol. Chem. 253: 2085–2092.
- Warner, E. A., Kanekanian, A. D. & Andrews, A. T. (2001) Bioactivity of milk proteins: 1. Anticariogenicity of whey proteins. Int. J. Dairy Technol. 54: 151–153.
- Mitoma, M., Oho, T., Shimazaki, Y. & Koga, T. (2001) Inhibitory effect of bovine milk lactoferrin on the interaction between a streptococcal surface protein antigen and human salivary agglutinin. J. Biol. Chem. 276: 18060–18065.
- Oho, T., Mitoma, M. & Koga, T. (2002) Functional domain of bovine milk lactoferrin which inhibits the adherence of Streptococcus mutans cells to a salivary film. Infect. Immun. 70: 5279–5282.
- Lenander-Lumikari, M., Mansson-Rahemtulla, B. & Rahemtulla, F. (1992) Lysozyme enhances the inhibitory effects of the perioxidase system on glucose metabolism of Streptococcus mutans. J. Dent. Res. 71: 484–490.
- Grenby, T. H., Andrews, A. T., Mistry, M. & Williams, R.J.H. (2001) Dental caries-protective agents in milk and milk products: investigations in vitro. J. Dentistry 29: 83–92.
- Eigel, W. N. & Keenan, T. W. (1979) Identification of proteose peptone component 8-slow as a plasmin-derived fragment of bovine “-casein. Int. J. Biochem. 10: 529–535.
- Eigel, W. N. (1981) Identification of proteose peptone component 5 as a plamin-derived fragment of bovine “-casein. Int. J. Biochem. 13: 1081–1086.
- Neeser, J. R. (1991) Dental anti-plaque and anti-caries agent. U.S. Patent 4,992,420.
- Neeser, J. R. (1991) Dental anti-plaque and anti-caries agent. U.S. Patent 4,992,441.
- Zhang, Y. P. & Gaffar, A. (1998) Storage stable dentrifice composition containing an antibacterial casein glycomacropeptide adjuvant. U.S. Patent 5,741,773.
- Zhang, Y. P. & Gaffar, A. (1998) Fluoride dentifrices of enhanced efficacy. U.S. Patent 5,853,704.
- Zhang, Y. P. & Gaffar, A. (2001) Fluoride free dental remineralization. U.S. Patent 6,207,138.






