La formulazione di una razione è valida solo quanto è basata su una corretta analisi degli alimenti. L’approccio tipico è quello di campionare foraggi e concentrati, spedirli ad un laboratorio di riferimento e caricare i dati nel software di bilanciamento delle razioni. L’invio di un numero appropriato di campioni rappresentativi, unitamente alla comprensione dell’errore analitico di laboratorio, è fondamentale per decidere se mantenere o modificare la dieta in uso. L’articolo di questo mese si concentrerà sul protocollo di campionamento per i diversi alimenti.
Campioni rappresentativi
Per ottenere un campione rappresentativo è fondamentale, in primo luogo, valutare l’eterogeneità dei diversi alimenti. Campionare un pastone di mais quasi certamente garantisce un campione più rappresentativo rispetto a quando si campionano foraggi eterogenei come gli insilati o una miscelata (TMR).
Durante il campionamento, il diverso apporto di steli, foglie o granella (spezzato o farina), rappresenta una delle prime sfide per determinare il vero valore energetico dell’alimento.
La variazione nella composizione di una dieta dipende dalla variazione della composizione dei singoli componenti, dal tasso di inclusione di ciascun prodotto e dal numero di questi componenti nella dieta.
Su base teorica, il contributo di un alimento alla varianza della dieta cresce con il quadrato del suo tasso di inclusione. In altre parole, se si raddoppia la percentuale di inclusione di un alimento, il suo impatto sulla variazione della dieta aumenta di un fattore quattro. Questo è certamente qualcosa da considerare nelle razioni con alti tassi di inclusione di foraggio, come il silomais. Gli alimenti altamente variabili possono essere utilizzati con successo se i loro tassi di inclusione sono mantenuti bassi (Weiss e St.-Pierre, 2007). Questo può aiutare a spiegare un’osservazione personale secondo la quale gli alimentaristi che preparano razioni con molti alimenti tendono ad essere meno entusiasti dei nuovi metodi di laboratorio rispetto ai nutrizionisti che formulano diete più semplici, con meno ingredienti e a tassi di inclusione più elevati.
Campioni e sotto-campioni
Disporre di più campioni rappresentativi e delle relative analisi è la principale via per ridurre la variazione nei risultati analitici. Uno dei pregi dell’analisi basata sulla spettrometria nel vicino infrarosso (NIR) è la possibilità di ridurre l’errore analitico testando più campioni con un costo di laboratorio contenuto rispetto ai metodi di chimica umida.
L’approccio migliore, se possibile, per campionare i foraggi in trincea o da silos è di prelevare campioni direttamente al carico del carro miscelatore. Se si preleva sul fronte trincea è bene evitare qualsiasi area deteriorata nella zona superiore o laterale del fronte che verrebbe normalmente scartata dall’addetto al carro. Diversi sotto-campioni dovrebbero essere prelevati e riuniti in un secchio, da cui poi è prelevato il campione definitivo. Il volume del campione da inviare al laboratorio dovrebbe essere di circa 1-2 litri (Taysom, 2014). Analisi quali la valutazione fisica della dimensione delle particelle dei foraggi o dell’unifeed possono richiedere campioni più abbondanti. I saggi di fieno dovrebbero essere prelevati con una sonda apposita per ridurre la perdita di foglie che possono influire significativamente sui risultati dell’analisi.
The Miner Institute (Cotanch, 2008) riferisce che campionamenti fatti con le mani su foraggi di erba medica in campo o su rotoballe aperte possono variare per NDF dal 38% al 52% e per proteine dal 18% al 16%. Questo mostra chiaramente l’importanza di utilizzare una sonda specifica per il fieno.
Per balle quadrate di grandi dimensioni, il campione può essere prelevato nella parte centrale in qualsiasi punto, inserendo il carotatore con un angolo di 45 gradi sul lato. Per balle rotonde il campionamento può essere effettuato sul lato curvo con il carotatore perpendicolarmente al lato (Undersander et al., 2005).
Campioni rappresentativi di unifeed possono essere effettuati prelevando circa 10 sotto-campioni. Inserire una mano al centro dell’andana fino al polso evitando di schiacciare o scuotere il campione prima di depositarlo in un secchio di plastica (Robinson and Meyer, 2010).
Il campionamento alla raccolta fornisce una conoscenza anticipata della qualità della granella e del foraggio. Alcuni parametri però, come pH, acidi grassi volatili (VFA), digeribilità dell’amido e solubilità delle proteine, subiranno significative variazioni durante la conservazione, mentre altri non cambieranno quasi per nulla (proteina grezza, ADF e NDF) durante una fermentazione ragionevolmente normale (Dave Taysom).
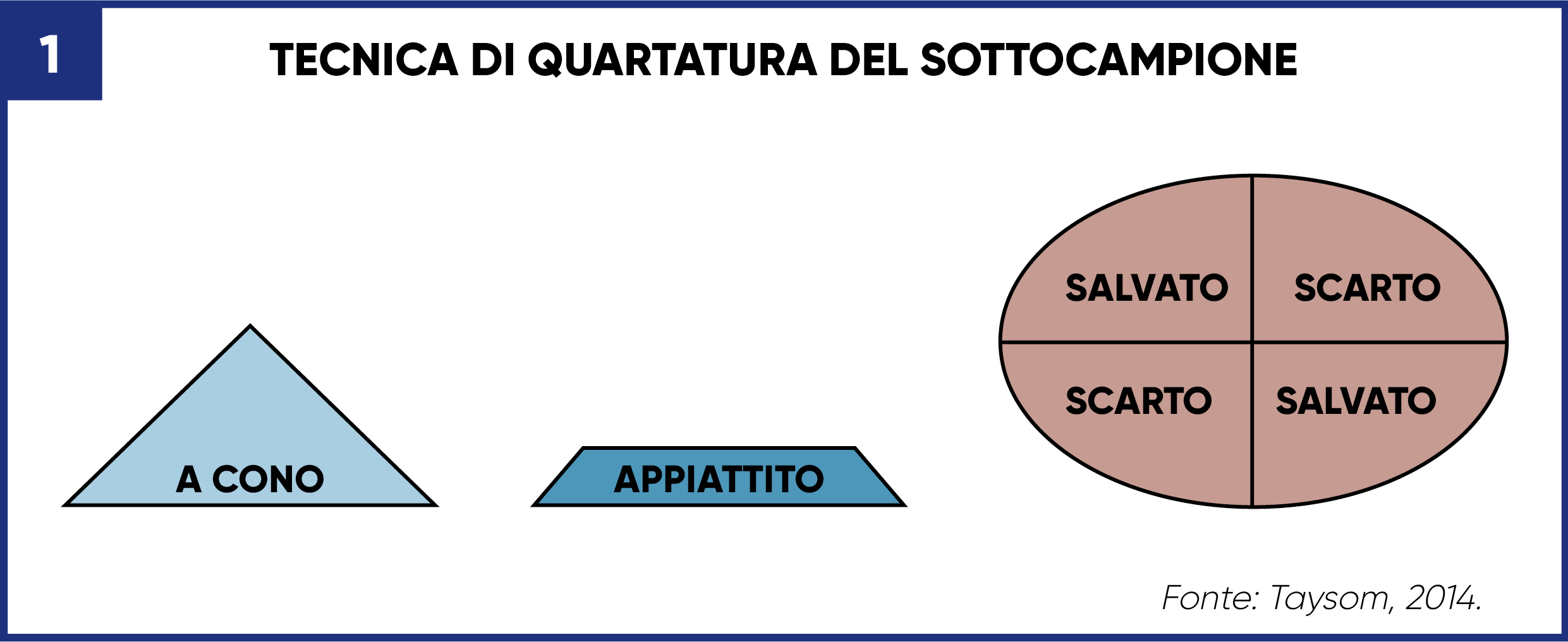
Il prelievo in azienda di un campione di concentrati può essere effettuato con la tecnica del quartering (figura 1). La metodica prevede una miscelazione accurata del materiale da campionare (ad esempio, arrotolandolo avanti e indietro su un foglio di plastica) che viene poi versato in una pila a forma di cono su una superficie pulita, successivamente appiattita. Si procede poi a dividere il campione appiattito in quattro parti uguali (quarti) usando un coltello, una cazzuola o uno strumento a bordi rettilinei. I due quarti opposti vengono scartati mentre i due quarti salvati sono raccolti, riuniti, mischiati e quartati nuovamente. E’ importante assicurarsi di raccogliere il materiale fine della parte inferiore del campione salvato.
Questo processo va ripetuto fino a quando non si raggiunge la quantità necessaria per un’analisi di laboratorio (Taysom, 2014). Se il campione presentato supera la quantità desiderata, il laboratorio stesso impiegherà la medesima tecnica per ridurne ulteriormente le dimensioni. Alcuni nutrizionisti sono favorevoli a un costo superiore di analisi purché il laboratorio asciughi e macini l’intero campione senza ulteriori riduzioni.
Un altro approccio per assicurare campioni rappresentativi, in particolare per l’analisi TMR, consiste nel misurare i livelli di minerali o fibre verificando che siano simili ai valori formulati con la dieta prima di inviare campioni per analisi più sofisticate e costose.
Infine, l’esperienza personale ha dimostrato che mentre l’accurato sotto-campionamento della dieta può essere controllato e standardizzato con metodiche, i problemi di miscelazione o di distribuzione della miscelata possono causare gravi difficoltà agli animali. Questa è la ragione per cui i nutrizionisti esperti tendono a dedicare più tempo ad osservare l’alimentazione piuttosto che allo stare seduti al computer.
Maneggiare il campione
L’approccio corretto alla gestione dei campioni dipende dal tipo di analisi richiesta. Per analisi chimiche normali o con tecnica NIR, partendo dal prodotto umido, è corretto congelare il prodotto e portarlo in laboratorio prima che si sciolga. È anche importante congelare i campioni se si richiedono analisi degli AGV, dei nitrati o acido prussico, in modo che gli organismi di deterioramento non siano attivi e la fermentazione secondaria non proceda durante la spedizione del campione.
Tuttavia, se si richiede l’analisi di microbi/funghi o per una più sofisticata cinetica di digestione, è meglio refrigerare il campione ed evitare il congelamento, ciò potrebbe causare la rottura delle cellule e determinare conteggi o tassi di digestione ingannevoli.
L’invio di campioni per l’analisi delle micotossine presenta un’ulteriore difficoltà. Infatti, mentre la maggior parte dei nutrienti come proteine, grassi e carboidrati sono distribuiti in modo uniforme, la presenza di micotossine è molto disomogenea.
Un secondo problema è misurare la presenza di una tossina a livello di parti per milione (ppm) o parti per miliardo (ppb). Quando la dimensione del campione è troppo ridotta, le tossine possono essere perse o rilevate a livelli molto inferiori rispetto a quelli effettivamente presenti.
Una studio indica una varianza totale del 53% associata alla presentazione di un campione da 5 chilogrammi di granella di mais contaminato con 20 ppb di aflatossina a causa del campionamento sul campo, del sotto-campionamento di laboratorio e dell’analisi di laboratorio (Whitaker et al., 1978). Si consiglia per l’analisi di micotossine su mais una dimensione minima del campione di almeno 2.5 kg (Romer Labs, 2014). La diluizione dell’inquinante è spesso considerata la soluzione migliore ed alcuni preferiscono analizzare l’alimento ammuffito come un indicatore dei livelli massimi di tossina che potrebbero essere presenti. Tuttavia, questo può essere molto fuorviante perché i funghi in crescita attiva potrebbero non produrre tossine, e queste zone contaminate potrebbero avere livelli inferiori rispetto ad altre aree in cui i funghi hanno subito stress ambientali prima del raccolto e in conservazione con la produzione di tossine.
Quanto? E con che Frequenza?
Alcuni alimentaristi applicano una media per i valori nutrizionali rilevati nel tempo piuttosto che apportare cambiamenti dietetici significativi basati su un’unica analisi. Ciò ha senso se la variabilità (deviazione standard) dell’alimento è relativamente piccola e non vi è alcun motivo apparente per cui la composizione debba essere significativamente modificata.
Le differenze tra le analisi potrebbero essere state causate da variazioni casuali fra carro e carro, da variazioni di campionamento o da entrambe. In questo caso, il nuovo dato potrebbe non essere migliore del vecchio, ma la media fra i due numeri ha la più bassa probabilità di essere sostanzialmente sbagliata (Weiss e St.-Pierre, 2007).
L’obiettivo dell’analisi è che il campione prelevato in azienda rispecchi il valore reale dell’intera massa. Il problema diventa definire la variabilità e il livello accettabile di confidenza richiesto per quel carattere.
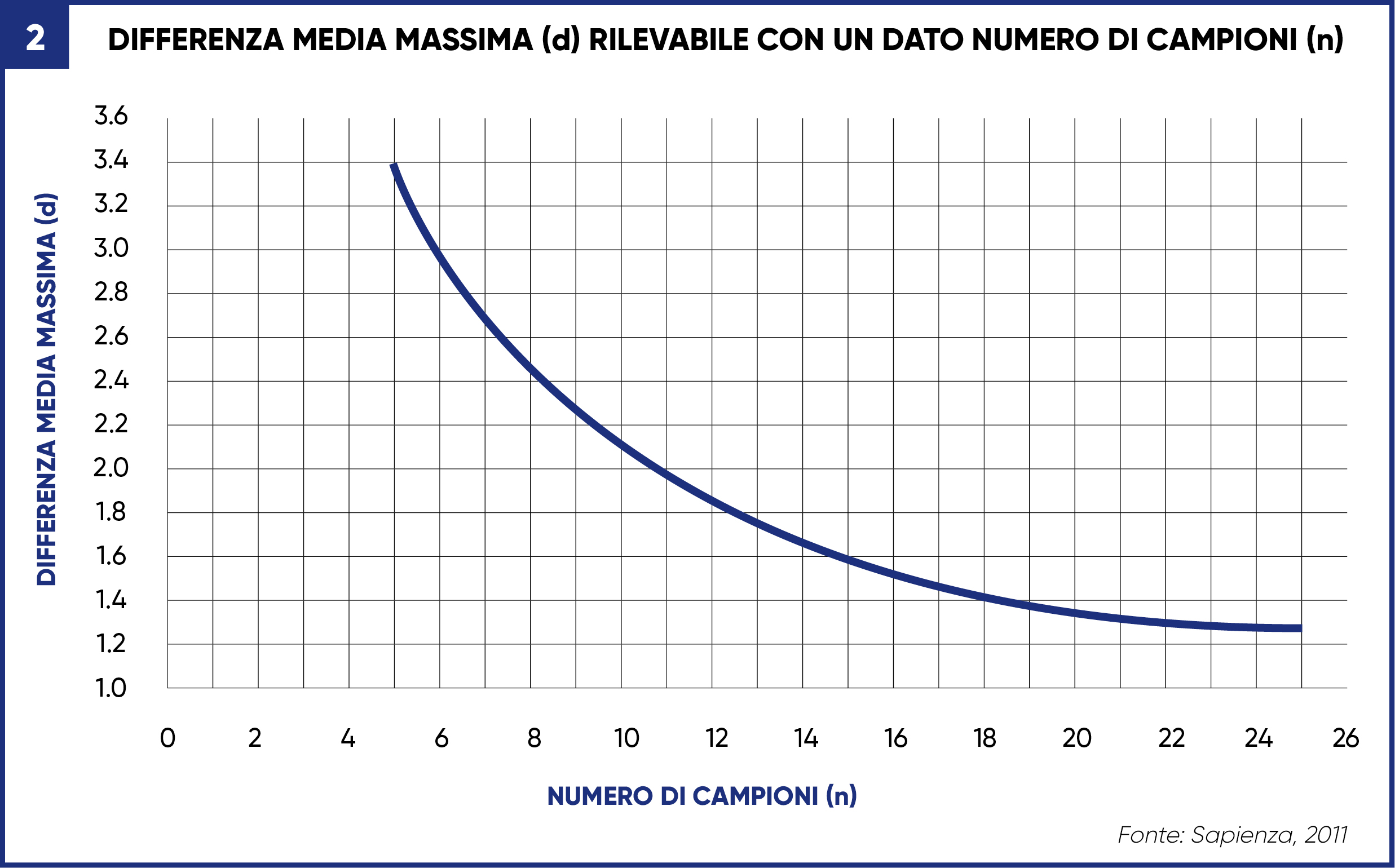
La Figura 2 fornisce le linee guida approssimative per il numero di campioni che dovrebbero essere considerati.
Il grafico assicura un coefficiente di variazione che rientra nei limiti ragionevoli per la maggior parte dell’umidità o dei caratteri nutrizionali misurati in laboratorio (Sapienza, 2001). La differenza media minima accettabile è determinata sull’asse Y e quindi viene referenziata attraverso il grafico fino a raggiungere l’intercetta della curva e facendo riferimento sull’asse X al numero approssimativo di campioni che devono essere prelevati.
Ad esempio, se una differenza del 2% è accettabile per il contenuto di amido di insilato di mais (ad es. 35%, che può variare dal 34% al 36%) e la popolazione è definita come un campo ragionevolmente uniforme con lo stesso ibrido, allora è necessario raccogliere 11 campioni dal campo, o se la popolazione è definita come una trincea contenente un ibrido questa deve essere campionata 11 volte (Sapienza, 2001).
In Sintesi
Campionare gli alimenti per l’analisi è una routine costosa ma necessaria per assicurare diete correttamente bilanciate ed economicamente sostenibili. È fondamentale, quando si modifica una razione, che i campioni siano ottenuti e gestiti in modo da assicurare dati veritieri da inserire nel software di razionamento.
L’implementazione di protocolli di campionamento e una loro rivalutazione periodica è fondamentale per l’efficienza e la produttività di ogni allevamento di vacche da latte.
Pubblicato su Feedstuffs Vol. 86, No. 46, 08 Dicembre 2014
 A cura di Bill Mahanna,
A cura di Bill Mahanna,
Iowa State University Global Nutritional Sciences Manager,
DuPont Pioneer