Effetti preventivi sul cancro del consumo di latte e lattici
Effetti degli ingredienti endogeni del latte sulla prevenzione del cancro
- Cancro del colon-retto
- Cancro al seno
- Cancro alle ovaie
- Cancro alla vescica
- Cancro alla prostata
Effetti delle sostanze esogene presenti nel latte sulla prevenzione del cancro
Composti funzionali arricchiti chimicamente
Composti funzionali arricchiti con batteri
Probiotici
Composti derivati dalla fermentazione
Effetti del latte e latticini sulla comparsa del cancro
Effetti degli ingredienti originariamente presenti nel latte sull’induzione del cancro
- Cancro alla prostata
- Cancro alle ovaie
- Cancro al seno
- Cancro alla vescica.
Effetti delle componenti esogene del latte sull’induzione del cancro
Contaminanti presenti nei latticini
- Pesticidi
- Farmaci veterinari
- Melammina
- Micotossine
- Altri contaminanti ambientali
Composti che si formano durante il processo di lavorazione dei latticini
H. Davoodi, S. Esmaeili e A.M. Mortazavian
L’Autore Davoodi è presso il Dept. of Clinical Nutrition and Dietology, National Nutrition and Food Technology Research Inst., Faculty of Nutrition Sciences, Food Science and Technology, Shahid Beheshti Univ. of Medical Sciences, P.O. Box 19395-4741, Tehran, Iran.
L’Autore Esmaeili è presso il Young Researchers Club, Varamin-Pishva Branch, Islamic Azad Univ., Varamin, Iran. Author Mortazavian is with Dept. of Food Science and Technology, National Nutrition and Food Technology Research Inst., Faculty of Nutrition Sciences, Food Science and Technology, Shahid Beheshti Univ. of Medical Sciences, P.O. Box 19395-4741 Tehran, Iran. Richieste dirette agli Autori Mortazavian (E-mail: mortazvn@sbmu.ac.ir/mortazvn@yahoo.com) e Esmaeili (E-mail: saeideh.esmaeili@gmail.com).
Comprehensive Reviews in Food Science and Food Safety
©2013 Institute of Food Technologists®
Abstract
Il latte è considerato l’unico alimento che contiene all’incirca tutte le diverse sostanze ritenute essere essenziali per l’alimentazione umana. Quando si parla di rischio di sviluppo del cancro, gli alimenti derivati dal latte vengono segnalati sia come protettivi che, occasionalmente, come nocivi. Le prove che i latticini possano proteggere dal cancro, o aumentarne il rischio di comparsa, non sono così schiaccianti. In linea generale, i comprovati benefici per la salute derivanti dal consumo di latticini superano di gran lunga le prove relative agli effetti dannosi. I latticini dovrebbero essere consigliati come parte di una dieta varia e nutriente, in quanto sono essenziali per mantenere una buona salute delle ossa e dei denti, per prevenire l’osteoporosi, i principali fattori di rischio di malattie cardiovascolari, l’ipertensione, il diabete di tipo 2, la sindrome metabolica, così come alcune tipologie di cancro. Il Cancer Council e l’USDA raccomandano il consumo di 3 porzioni di latte e di latticini al giorno. Questo articolo esamina il potenziale del latte e dei prodotti lattiero-caseari (e delle loro sostanze endogene o esogene) per quanto concerne l’inibizione del rischio di comparsa di differenti tipologie di cancro. Sono stati esaminati anche quei report condotti negli anni passati che suggerivano che il latte e l’industria lattiero-casearia fossero i responsabili delle cause di comparsa del cancro.
Introduzione
Il cancro è una delle cause primarie di morte e di invalidità a livello mondiale, responsabile di circa 7.6 milioni di decessi ogni anno. Il fatto che soltanto il 5-10% di tutti i casi di cancro sia dovuto a difetti genetici e che il restante 90-95% sia dovuto a fattori correlati allo stile di vita (come il fumo, la dieta, l’alimentazione, il consumo di alcol, l’inattività fisica, l’obesità e l’esposizione al sole), alla presenza di infezioni e all’esposizione agli inquinanti ambientali, ci offre grandi opportunità quando parliamo di prevenzione (La Vecchia e altri 1991). Tra i fattori legati allo stile di vita, è universalmente riconosciuto come l’alimentazione e gli aspetti ad essa correlati svolgano un ruolo importante nell’insorgenza del cancro (Gonzalez e Riboli 2010). Prove ottenute da studi osservazionali suggeriscono che circa il 30-40 % dei casi di cancro possono essere potenzialmente prevenuti modificando gli aspetti nutrizionali e i modelli di consumo alimentari (Marmotta e altri 2007). Il latte e i prodotti lattiero-caseari vengono riconosciuti come alimenti funzionali, il che ci suggerisce come il loro utilizzo abbia un effetto diretto e significativo sulla salute, e il loro consumo viene correlato ad una diminuzione del rischio di comparsa di numerosi tumori (Keri Marshall 2004). Il latte e i latticini erano riconosciuti come alimenti importanti già nel 4000 a.C., come testimoniano i disegni sulla pietra ritrovati nel deserto del Sahara. Si tratta di una delle componenti più importanti della dieta umana, in particolare nel mondo occidentale ma sempre di più anche in Asia (Tsuda e altri 2000). Il latte è considerato l’unico alimento che contiene approssimativamente tutte le diverse sostanze ritenute essenziali per l’alimentazione umana (Goodman e altri 2002; Laakkonen e Pukkala 2008). Il latte è un’importante fonte di proteine, calcio e vitamine del gruppo B (tiamina, riboflavina, niacina, vitamina B6 e folato) e fornisce vitamina A, vitamina C, magnesio e zinco (Jelen 2005; Miller e altri 2007). I carboidrati sono sotto forma di lattosio, zucchero che generalmente viene considerato a basso indice di cancerogenità. Inoltre, circa 1/3 del grasso del latte intero è monoinsaturo e fornisce piccole quantità di acidi grassi essenziali. Il latte è una delle principali fonti dietetiche di acido linoleico coniugato (CLA), anche se rappresenta una componente minore del grasso del latte (Jelen 2005). Diversi costituenti del latte come la vitamina D, le proteine, il calcio, il CLA, il butirrato, gli acidi grassi saturi e alcuni contaminanti come pesticidi, estrogeni e il fattore di crescita insulino-simile tipo I (IGF-I) sono ritenuti responsabili di una eventuale e futura correlazione negativa tra latticini e comparsa di tumori (McCann e altri 2004; Moorman e Terry 2004; Parodi 2005; Bingham e Day 2006; Cui e Rohan 2006; Laakkonen e Pukkala 2008). I principali composti presenti nel latte e nei prodotti lattiero-caseari che potrebbero influire sulla comparsa del cancro possono essere classificati in gruppi differenti e sono mostrati in figura 1. Questo articolo esamina gli effetti preventivi e induttivi dei latticini sul rischio di comparsa del cancro.

Figura 1. Principali sostanze presenti nel latte e nei latticini che possono influire sullo sviluppo del cancro.
Effetti preventivi sul cancro del consumo di latte e latticini
Effetti degli ingredienti endogeni del latte sulla prevenzione del cancro
Gli effetti benefici degli ingredienti originariamente contenuti nel latte e nei prodotti lattiero-caseari sulla comparsa dei tumori e sui meccanismi correlati, sono discussi di seguito ed illustrati nella figura 2.

Figura 2. Effetti degli ingredienti originariamente contenuti nel latte sul cancro e rispettivi meccanismi.
Cancro del colon-retto
Il cancro del colon-retto è la terza tipologia di cancro più diffusa al mondo, con circa 1.2 milioni di nuovi casi diagnosticati nel 2008, pari al 9.7% di tutti i tumori (Ferlay e altri nel 2010). Un aumento del consumo di latte o di prodotti lattiero-caseari viene associato ad una significativa riduzione del cancro al colon (Elwood e altri 2008). Cho e altri (2004a) hanno condotto una vasta analisi pooled di dati provenienti da 10 coorti (n = 534, 536) di 5 Paesi, ed hanno individuato 4992 soggetti con diagnosi di cancro del colon-retto al follow-up. Gli individui che consumavano più di un bicchiere di latte ( ≥ 250 g/die) presentavano una diminuzione del 15% del rischio di sviluppare un cancro del colon-retto (rischio relativo 0.85, IC 95% 0.78-0.94), rispetto ai soggetti che consumavano porzioni < 70 g/die. Diversi meccanismi possono spiegare l’effetto protettivo che hanno i latticini sul rischio di comparsa del cancro del colon-retto (Norat e Riboli 2003; Larsson e altri 2005). I risultati di un ampio studio prospettico di coorte mostravano l’esistenza di una correlazione inversa tra tumori dell’apparato digerente, latticini e calcio sia negli uomini che nelle donne, e in particolare con il cancro del colon-retto (Park e altri 2009). Numerosi studi (epidemiologici, sugli animali, di laboratorio e clinici) indicano come una maggiore assunzione di calcio (e/o di alimenti derivati dal latte) riduca il rischio di cancro al colon (Cho e altri 2004a; Chan e Giovannucci 2010). Assunzioni di calcio dai 1200 ai 1500 mg/die, o di 4 porzioni di latticini al giorno, sembrerebbero essere le più protettive contro lo sviluppo del cancro colorettale (Holick 2008). I prodotti lattiero-caseari sono una delle principali fonti alimentari di calcio, sostanza che sembrerebbe in grado di favorire la prevenzione del cancro al colon andando a legare gli acidi biliari secondari e gli acidi grassi ionizzati, riducendo così i loro effetti stimolanti la proliferazione epiteliale a livello del colon (Govers e van der Meet 1993). Inoltre, è stato dimostrato che il calcio può influenzare molteplici vie intracellulari che portano alla differenziazione nelle cellule normali e all’apoptosi nelle cellule trasformate (Newmark e altri 1984; Lamprecht e Lipkin 2001; Fedirko e altri 2009) e può ridurre il numero di mutazioni nel gene K-ras nelle neoplasie del colon-retto nel ratto (Llor e altri 1991; Aune e altri 2012). Numerosi studi clinici hanno evidenziato una riduzione della proliferazione cellulare nel colon e nel retto dopo assunzione di calcio e latticini (Holt e altri 1998; Karagas e altri 1998; Holt e altri 2001; Ahearn e altri 2011). I dati raccolti da 10 studi di coorte hanno dimostrato una riduzione del 12% del rischio di cancro al colon per ogni 500 ml di aumento di consumo di latte. C’è stata una riduzione del 17% dell’incidenza del cancro al colon-retto con un consumo di ricotta superiore ai 25 mg/die (Cho e altri 2004a, b). Studi epidemiologici sul consumo e studi d’intervento, hanno dimostrato che la somministrazione di calcio può ridurre la comparsa di polipi adenomatosi colorettali e i tassi di comparsa del cancro, e questo effetto può essere prolungato nel tempo (Holt 2008). Inoltre, i risultati di uno studio caso-controllo condotto in Nuova Zelanda hanno rivelato come il consumo giornaliero di latte durante l’infanzia possa ridurre l’incidenza del cancro colorettale, probabilmente attraverso l’azione del calcio sullo sviluppo dell’adenoma. La partecipazione ai programmi di distribuzione del latte nelle scuole è stata associata ad una diminuzione del 2.1% degli odds ratio per il cancro del colon-retto per ogni 100 bottiglie da mezza pinta bevute (1 bottiglia da mezza pinta = 284 ml) (Cox e Sneyd 2011). La maggior parte delle prove suggerisce che l’effetto del calcio è dipendente, o parzialmente correlato, all’assunzione simultanea di vitamina D. La vitamina D può ridurre il rischio di sviluppo del cancro al colon anche indipendentemente dalla presenza di maggiori quantità di calcio o di latticini nella dieta (Holt 2008). La vitamina D modula gli effetti del calcio sulla carcinogenesi colorettale (Mizoue e altri 2008). I risultati di uno studio caso-controllo condotto su larga scala sulla popolazione giapponese hanno evidenziato l’esistenza di correlazioni inverse tra il calcio e la vitamina D della dieta e il rischio di cancro al colon-retto, dimostrando come una modificazione della dieta utile ad aumentare l’assunzione di calcio (mantenendo al contempo un adeguato livello di assunzione di vitamina D con la dieta e l’esposizione moderata al sole) avesse un grande potenziale nella prevenzione del cancro al colon-retto tra gli adulti giapponesi (Mizoue e altri 2008). In studi sperimentali alcuni grassi presenti nei latticini, tra cui il CLA e l’acido butirrico (Liew e altri 1995), hanno dimostrato di possedere un effetto protettivo (Hague e Paraskeva 1995; Parodi 1997). I risultati di uno studio di coorte condotto nelle donne svedesi mostravano che le donne che consumavano ≥ 4 porzioni al giorno di latticini ad elevato contenuto di grassi (compreso il latte intero, il latte intero fermentato, il formaggio, la panna, la panna acida e il burro) avevano un rapporto del tasso multivariato di cancro al colon-retto di 0.59 (IC 95%: 0.44, 0.79; P trend = 0.002) rispetto alle donne che consumavano < 1 porzione/die. Ogni aumento di 2 porzioni al giorno di latticini ad elevato contenuto di grassi corrispondeva ad una riduzione del 13% del rischio di cancro al colon-retto (rapporto di tasso multivariato: 0.87; IC 95%: 0.78, 0.96) (Larsson e altri 2005). La caseina, che rappresenta quasi l’80% delle proteine del latte vaccino, possiede proprietà anti-tumorali (Goeptar e altri 1997). La caseina può proteggere dal cancro al colon tramite l’inibizione degli enzimi prodotti dai batteri intestinali, responsabili della deconiugazione dei glucuronidi procarcinogeni in agenti cancerogeni; inoltre, la caseina protegge dal cancro al colon anche grazie al suo effetto sul sistema immunitario, soprattutto per la sua capacità di simulare l’attività fagocitaria e di aumentare i linfociti (Parodi 1998). Altri ricercatori suggeriscono che sia la struttura molecolare della caseina a garantire le sue proprietà anti-tumorali (MacDonald e altri 1994). Inoltre in Australia, alcuni ricercatori hanno evidenziato una diminuzione dei focolai di cripte aberranti, marker precancerosi, nel colon prossimale di ratti alimentati con mangime a base di proteine del siero di latte e trattato con un agente chimico cancerogeno (Belobrajdic e altri 2003).
Cancro al seno
Il cancro al seno è il tumore più comune, con un numero di 1.4 milioni di donne alle quali è stato diagnosticato un tumore al seno nel 2010 (Dong e altri 2011; Duarte e altri 2011). Studi sperimentali condotti su animali e in vitro hanno dimostrato gli effetti protettivi del CLA sulla carcinogenesi nella ghiandola mammaria, grazie alla potenziale inibizione della cicloossigenasi-2 o della via della lipossigenasi o grazie all’induzione dell’espressione di geni apoptotici (Kelley e altri 2007). Nel Nurses’ Health Study II (Cho e altri 2003), le donne che consumavano un numero elevato di latticini a basso contenuto di grassi durante gli anni della pre-menopausa, mostravano una correlazione non significativa con il rischio di cancro al seno. I risultati di una meta-analisi di studi prospettici di coorte indicavano che il consumo di latticini a basso contenuto di grassi, ma non di quelli ad elevato contenuto di grassi, era correlato ad una diminuzione del rischio di comparsa di cancro al seno, cosa che sostanzialmente è in linea con le attuali evidenze (Dong e altri 2011). In alcuni studi prospettici, l’assunzione di calcio appariva inversamente correlata alla diminuzione del rischio di cancro al seno (Knekt e altri 1996; McCullough e altri 2005). I risultati di uno studio prospettico di coorte basato sulla popolazione evidenziavano l’esistenza di una correlazione negativa tra il rischio di cancro al seno (in pre- e in post-menopausa) e l’assunzione di calcio. I risultati mostravano anche una diminuzione del 50% del rischio di cancro al seno in pre-menopausa nelle donne che consumano 25 g di formaggio bianco al giorno rispetto alle donne che ne consumavano meno di 6 g/die (Hjartåker e altri 2010). Il calcio può esercitare le sue proprietà anti-tumorali attraverso diversi meccanismi: a) diminuzione della proliferazione cellulare ed induzione della differenziazione delle cellule mammarie (Cui e Rohan 2006), b) probabilmente lega e neutralizza gli acidi grassi e gli acidi biliari mutageni (Parodi 2005), e c) diminuisce l’eccessiva proliferazione epiteliale indotta dai grassi nelle ghiandole mammarie dei roditori. Da un punto di vista metabolico, il calcio è strettamente correlato alla vitamina D, che si è dimostrata anche in grado di influenzare la carcinogenesi a livello del seno, ed è stato ipotizzato che alcuni degli effetti anti-tumorali del calcio possano essere mediati dalla vitamina D (Cui e Rohan 2006). Ad esempio, il calcio può giocare un ruolo importante nell’apoptosi indotta da 1,25(OH)2 D (la forma attiva della vitamina D) (Sergeev 2005). Una recente meta-analisi ha fornito la prova che la vitamina D e l’assunzione di calcio proteggono dal cancro al seno, in particolare nelle donne in pre-menopausa (Chen e altri 2010). I risultati ottenuti da un ampio studio di coorte hanno evidenziato che le donne con la più alta assunzione di calcio nella dieta (>1250 mg/die) mostravano un rischio minore di sviluppare un cancro al seno rispetto a quelle che riferivano di assunzioni ≤ 500 mg/die [RR, 0.80; intervallo di confidenza del 95% (IC 95%), da 0.67 a 0.95; P = 0.02] (McCullough e altri 2005). I risultati di quest’ultimo studio sostengono la teoria secondo la quale il calcio assunto con la dieta e/o alcune altre componenti presenti nei latticini possano ridurre il rischio di comparsa del cancro al seno nella post-menopausa. Le proteine e i peptidi presenti nel latte vengono identificati come agenti preventivi del cancro (Knekt e altri 1996; Tsuda e altri 2000; Wakabayashi e altri 2006; Rodrigues e altri 2008). Un esempio è la lattoferrina (LF), nota anche per la sua azione inibitoria nei confronti della proliferazione cellulare e per le sue capacità antiinfiammatorie e antiossidanti (Tsuda e altri 2002; Ward e altri 2005; Rodrigues e altri 2008; Iigo e altri 2009. La LF è una glicoproteina legante il ferro della famiglia delle transferrine. Studi in vivo hanno dimostrato che la somministrazione orale di LF bovina ai roditori riduce significativamente la carcinogenesi indotta chimicamente in diversi organi (mammelle, esofago, lingua, polmone, fegato, colon e vescica) ed inibisce l’angiogenesi (Tsuda e altri 2002; Iigo e altri 2009). Anche se i meccanismi d’azione della LF non sono ancora del tutto compresi, esistono prove della sua capacità di interagire con alcuni recettori, così come di modulare l’espressione genica di diverse molecole che sono vitali per il ciclo cellulare e per il meccanismo dell’apoptosi.
Cancro alle ovaie
Il cancro alle ovaie ha il più alto tasso di mortalità tra tutti i tumori ginecologici ed è la quarta causa di morte per cancro nelle donne (Lefkowitz e Garland 1994). C’è grande interesse per quanto riguarda la possibilità che la vitamina D possa essere una sostanza antitumorale ad ampio spettro (Giovannucci 2005). Il cancro ovarico è una delle patologie maligne che è stata collegata alla vitamina D (Lefkowitz e Garland 1994; Grant 2003). Ci sono prove di come l’epitelio delle ovaie presenti dei recettori per la forma attiva della vitamina D (Saunders e altri 1992) e studi in vitro hanno mostrato che la crescita delle cellule del carcinoma ovarico può essere inibita dalla vitamina D e dai suoi analoghi (Saunders e altri 1995; Friedrich e altri 2003). Studi sulla dieta suggeriscono un ruolo chiave della vitamina D e del calcio nella prevenzione del cancro alle ovaie (Toriola e altri 2010). Ci sono spiegazioni biologiche per sospettare del fatto che la forma attiva della vitamina D, 1,25-(OH)2 D (Brommage e Deluca 1985) possa essere correlata all’incidenza del cancro alle ovaie e alla mortalità. Ad esempio, il recettore nucleare per la vitamina D, che media l’effetto del 1,25-(OH)2 D (3:34), si ritrova in modelli di tumore ovarico umano e nelle linee cellulari (Saunders e altri 1992; Ahonen e altri 2000; Villena-Heinsen e altri 2002). Inoltre, l’1,25-(OH)2 D (Brommage e Deluca 1985) inibisce la proliferazione cellulare nelle linee cellulari del cancro ovarico (Saunders e altri 1995; Ahonen e altri 2000) ed induce l’apoptosi (Jiang e altri 2004). In alcuni studi, ma non in tutti, è stata segnalata una correlazione inversa tra calcio della dieta e cancro alle ovaie (Kushi e altri 1999; Bidoli e altri 2001; Goodman e altri 2002; Genkinger e altri 2006; Koralek e altri 2006; Park e altri 2009). Sebbene i processi biologici mediante i quali il calcio sia in grado di influenzare la comparsa del cancro alle ovaie siano in larga parte sconosciuti, i possibili meccanismi includono: a) gli effetti del calcio sull’apoptosi, sulla crescita e sulla proliferazione cellulare (McConkey e Orrenius 1997; Ramasamy 2006), b) gli effetti del recettore del calcio (CaR) sulla proliferazione e sulla differenziazione cellulare (Rodland 2004; Ramasamy 2006) e c) gli effetti del calcio sulla down-regulation della produzione dell’ormone paratiroideo (PTH) (Grant 2007). Quindi, diminuendo la produzione di PTH, il calcio è potenzialmente in grado di mitigare gli effetti mitogeni e antiapoptotici del PTH stesso. I risultati di uno studio caso-controllo hanno indicato che il consumo di latte a basso contenuto di grassi era inversamente correlato al rischio di sviluppo di un cancro alle ovaie (Toriola e altri 2010).
Cancro alla vescica
Il cancro alla vescica è il nono tumore maligno più comune al mondo (Parkin e altri 2005). Il ruolo della dieta e dell’alimentazione nella carcinogenesi della vescica è plausibile, poiché la maggior parte delle sostanze o dei metaboliti, compresi gli agenti cancerogeni, vengono escreti attraverso le vie urinarie (Vecchia e Negri 1996; Larsson e altri 2008). Il consumo di latte e di latticini è stato associato ad una diminuzione dell’incidenza del cancro alla vescica. Le meta-analisi di dati provenienti da studi di coorte supportano l’esistenza di una correlazione inversa tra il consumo di latte e il rischio di sviluppare tumori del colon-retto e della vescica (Vecchia e Negri 1996; Lampe 2011). È stato affermato che il consumo di latte scremato e di latte fermentato a basso contenuto di grassi è inversamente correlato al rischio di comparsa di cancro alla vescica, mentre il latte intero ad elevato contenuto di grassi è positivamente correlato a tale rischio (Mao e altri 2011). La caseina è la principale proteina del latte scremato in polvere e mostra un’analoga attività antitumorale (McIntosh e altri 1995). Negli animali da laboratorio, si è visto che diete contenenti siero di latte riducono la comparsa dei tumori del colon e della mammella (Hakkak e altri 2001; McIntosh e Le Leu 2001).
Cancro alla prostata
Il cancro alla prostata (PCa) è la seconda tipologia di cancro più frequente nei maschi (Greenlee e altri 2000). Mentre è noto come i fattori genetici abbiano un ruolo nello sviluppo del cancro ereditario alla prostata (HPC) (Nwosu e altri 2001; Carpten e altri 2002; Rökman e altri 2002), solo recentemente sono stati svelati gli effetti protettivi e/o i benefici terapeutici derivanti da varie componenti della dieta (Chan e altri 1998; Blumenfeld e altri 2000; Schmitz-Drager e altri 2001; Schulman e altri 2001; Jankevicius e altri 2002). L’interesse nei confronti della vitamina D come agente preventivo del cancro alla prostata deriva da diverse osservazioni epidemiologiche (Jemal e altri 2004). Prove di laboratorio indicano che elevati livelli circolanti di vitamina D e del suo metabolita attivo 1,25(OH)2 D (dalle 500 alle 1000 volte più attivo della vitamina D) inibiscono, in vitro, la carcinogenesi della prostata, riducendo la proliferazione cellulare prostatica e migliorando la differenziazione cellulare (Reichel e altri 1989; Klein 2005). Inoltre, l’induzione dell’apoptosi (Blutt e altri 2000) impedisce l’adesione e la migrazione cellulare (Sung e Feldman 2000) ed inibisce la metastatizzazione (Lokeshwar e altri 1999), anche se l’assunzione con la dieta di latticini ricchi di calcio, che abbassa il livello sierico di vitamina D, viene correlata ad un aumento del rischio di sviluppo del cancro alla prostata (Thompson e altri 2003; Parodi 2009). Nel grasso del latte abbiamo un certo numero di componenti, come sfingolipidi, CLA, acido butirrico, acidi grassi a catena ramificata e vitamine liposolubili, che nei modelli animali si sono mostrati dotati di un’azione antitumorale (Parodi 1999; Parodi 2008).
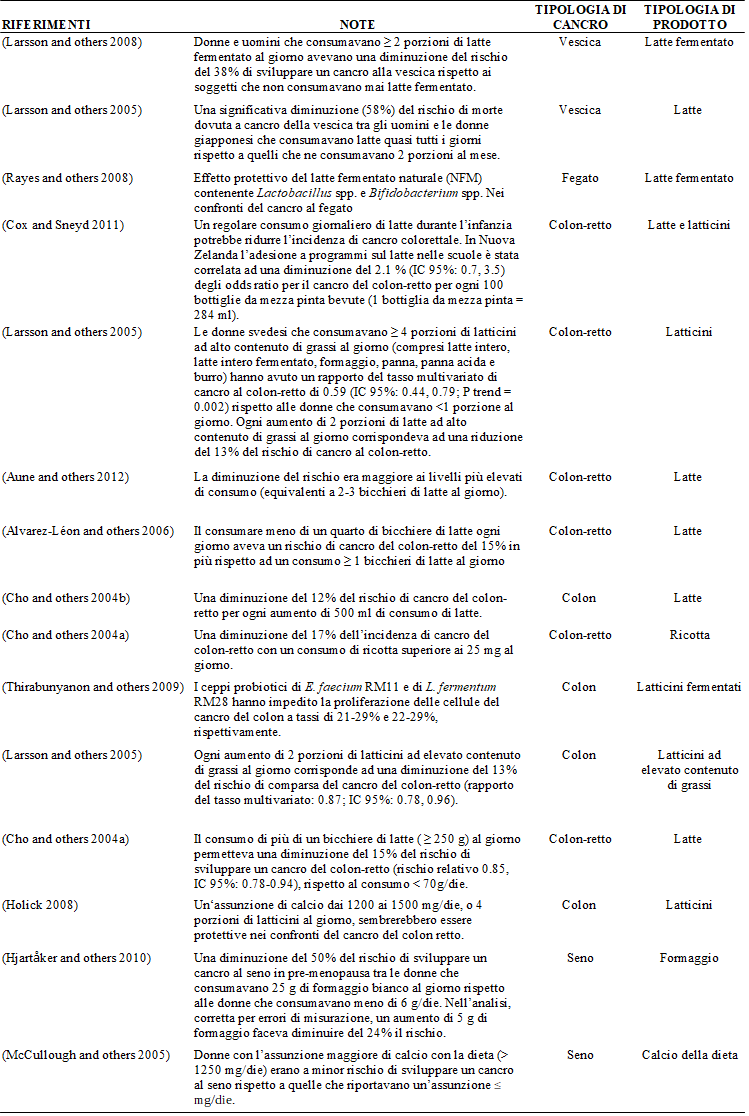
Tabella 1. Pubblicazioni selezionate sulla prevenzione del cancro esercitata dalle componenti originarie contenute nel latte e nei latticini.
Anche le proteine del latte possiedono proprietà antitumorali (Parodi 2007).Vari studi indicano che le proteine del latte, come la caseina e soprattutto le proteine del siero di latte, possono proteggere da alcuni tumori come quelli del colon, del seno e della ghiandola prostatica (Parodi 2007). Le proprietà antitumorali delle proteine presenti nel siero di latte bovino possono essere attribuite alla loro capacità di aumentare i livelli cellulari di glutatione, un antiossidante. Inoltre, le proteine del siero di latte possono ridurre il rischio di comparsa del cancro andando a migliorare le risposte immunitarie ormonali e cellulo-mediate (Parodi 1998; Bounous 2000; Micke e altri 2001; Parodi 2001; Eliassen e altri 2002; Walzem e altri 2002; Kent e altri 2003; Tsuda e altri 2010). È stato visto che proteine del siero di latte come lattoalbumina, lattoglobulina, lattoferrina, lattoperossidasi e immunoglobuline possiedono effetti biologici tra cui un’attività antitumorale (McIntosh e altri 1998). Pubblicazioni selezionate relative alla prevenzione del cancro esercitata dalle componenti originariamente presenti nel latte e nei latticini sono elencate nella tabella 1.
Effetti delle sostanze esogene presenti nel latte sulla prevenzione nel cancro
Composti funzionali arricchiti chimicamente
Un alimento può essere definito “funzionale” se si dimostra adeguatamente in grado di influire positivamente su uno o più bersagli funzionali del corpo, oltre ad avere corretti effetti nutrizionali (Saxelina e altri 2003). I derivati del latte arricchiti con sostanze funzionali sono prodotti con un valore aggiunto costituiti da latte o latticini che contengono almeno un componente di derivazione chimica o batterica che abbia un comprovato beneficio per la salute. I prodotti lattiero-caseari arricchiti con minerali e vitamine sono i più importanti derivati del latte fortificati, poiché in molti paesi in via di sviluppo le carenze di vitamine e di minerali sono un grave problema di salute pubblica, e spesso si possono verificare anche nei paesi industrializzati. Le più comuni integrazioni di minerali e di oligoelementi riguardano ferro, zinco, selenio, iodio e calcio. Ad oggi le carenze vitaminiche più importanti sono probabilmente quelle che riguardano la vitamina A, la vitamina D e l’acido folico (Saxelin e altri 2003). L’integrazione di calcio negli alimenti e nei prodotti lattiero-caseari sta guadagnando sempre più campo visto l’aumento della consapevolezza dell’importanza di un maggiore apporto di questo minerale con la dieta. Oltre alla prevenzione dell’osteoporosi, un adeguato apporto di calcio viene correlato ad una diminuzione del rischio di ipertensione, di cancro del colon, di calcoli renali e di assorbimento del piombo (McCarron e Heaney 2004). Pertanto, il latte liofilizzato e il latte in polvere aromatizzato vengono spesso arricchiti con vitamine A e D, calcio e ferro (Singh e altri 2007). Anche se i latticini sono un’ottima fonte dietetica di calcio, possono essere ulteriormente fortificati con l’aggiunta di sali di calcio per ottenere un maggiore apporto di minerale per porzione (Vyas e Tong 2004). Negli Stati Uniti la dose giornaliera raccomandata per il calcio è di 800 e 1200 mg/d per bambini e per gli adulti, rispettivamente (RDA e Raccomandazioni 1989). Al giorno d’oggi, l’integrazione del calcio in prodotti come il formaggio, il gelato, il latte scremato e lo yogurt è una pratica comune. La carenza di ferro è una carenza nutrizionale comune in tutto il mondo, che colpisce soprattutto i neonati, i bambini piccoli e le donne in età fertile. I prodotti lattiero-caseari sono una fonte importante di sostanze nutrienti, ma hanno un basso contenuto di ferro. La fortificazione di questi prodotti può incrementare l’assunzione media di ferro con la dieta (Zhang e Mahoney 1989). Tra i latticini che più frequentemente vengono arricchiti con ferro ricordiamo il formaggio cheddar, il brunost, la mozzarella, il formaggio bianco a pasta molle, il baker’s cheese, i fiocchi di latte, il formaggio Harvatti, lo yogurt (magro e a basso contenuto di grassi) e il latte al cioccolato (Zhang e Mahoney 1991; Biebinger e altri 2008). Lo zinco è necessario per l’attività di oltre 100 enzimi specifici coinvolti nelle principali vie metaboliche, che regolano aspetti come la crescita fisica, lo sviluppo delle competenze immunitarie, la funzione riproduttiva e lo sviluppo neurocomportamentale. Il formaggio cheddar arricchito con zinco potrebbe essere un’eccellente alimento utile per il reintegro dei livelli di questo minerale nei gruppi a rischio di carenza (Biebinger e altri 2008; Kahraman e Ustunol 2012). Le prove in nostro possesso dimostrano che le attuali assunzioni di vitamina D negli adulti sono inadeguate (Vieth 2001). Diversi studi suggeriscono come concentrazioni più elevate di vitamina D nel siero siano correlate a tassi più bassi di tumori al seno, alle ovaie, alla prostata e al colon-retto, così come risulta essere diminuito il rischio di sviluppare la sclerosi multipla (Vieth 2001). Pertanto, l’integrazione del latte, del formaggio, dello yogurt, delle bevande a base di latte fermentato e del gelato con vitamina D3 è un importante programma di salute pubblica (Kazmi e altri 2007). La vitamina A è una vitamina liposolubile e rappresenta un gruppo di sostanze necessarie per l’attività riproduttiva, la differenziazione cellulare, il funzionamento del sistema immunitario, la regolazione genica e la vista. La fortificazione del latte intero con vitamina A è facoltativa, mentre la fortificazione del latte magro e del latte scremato è fortemente raccomandata e persino obbligatoria in alcuni paesi, in seguito alla rimozione con la panna dopo centrifugazione delle vitamine liposolubili. È stato riconosciuto il ruolo protettivo dell’acido folico nella riduzione dei difetti di sviluppo del tubo neurale, delle malattie coronariche e del cancro (Gangadharan e Nampoothiri 2011). L’acido folico si è anche dimostrato capace di ridurre il rischio di comparsa dei tumori del colon-retto e del seno (Prinz-Langenohl e altri 2001). Il latte e i latticini fermentati sono una buona fonte di folati naturali e di proteine leganti i folati che ne migliorano la biodisponibilità e la stabilità (Gangadharan e Nampoothiri 2011). L’acido folico può essere aggiunto con successo allo yogurt semplice, fino a raggiungere la dose giornaliera raccomandata di 400 μg (Boeneke e Aryana 2007). Il CLA esercita una forte influenza positiva sulla salute umana, ma la sua assunzione è solitamente troppo bassa e se ne raccomanda un maggiore consumo. Un buon modo per aumentare il contenuto di CLA nella dieta (senza dover modificare le abitudini alimentari) è l’arricchimento degli alimenti comunemente consumati con integrazioni di CLA (Rodríguez-Alcalá e Fontecha 2007). Molti studi hanno dimostrato la fattibilità della realizzazione di latticini arricchiti con CLA che mantengano accettabili caratteristiche sensoriali e durata di conservazione (Jones e altri 2005). I prodotti prebiotici contengono un ingrediente prebiotico (non digeribile) che influisce positivamente sull’ospite che lo assume andando a stimolare selettivamente la crescita e/o l’attività dei batteri probiotici del colon (Mohammadi e altri 2012). Queste sostanze non vengono digerite nel tratto gastroenterico superiore, a causa dell’incapacità degli enzimi digestivi, ma vengono digerite a livello del colon (Schrezenmeir e de Vrese 2001). I prodotti finali della fermentazione intestinale sono principalmente acidi grassi a catena corta (acido propionico e acido butirrico), acido lattico, acido acetico, idrogeno, metano e anidride carbonica. È noto come gli acidi grassi a catena corta, specialmente l’acido butirrico, si comportino come fonte di energia per gli enterociti (Wollowski e altri 2001). Heydari e altri (2011) hanno studiato gli effetti dell’aggiunta di diversi prebiotici allo yogurt e le sue caratteristiche chimiche, mirobiologiche e sensoriali (Heydari e altri 2011). Mohammadi e Mortazavian (2010) hanno esaminato gli aspetti tecnologici dei prebiotici nel latte fermentato probiotico (Mohammadi e Mortazavian 2010). Le microalghe (biomassa cianobatterica) possono essere aggiunte al latte fermentato per incrementare le caratteristiche funzionali del prodotto (Varga e altri 2002). Spirulina e chlorella sono microalghe blu-verdi che contengono elevati composti antiossidanti, molteplici aminoacidi, proteine di alta qualità, Fe, Ca, acidi grassi insaturi e molte vitamine tra cui A, B2, B6, B9, B12, E e K. Hanno effetti antivirali, antinfiammatori e antitumorali e abbassano il profilo lipidico del sangue, la glicemia, riducono il peso corporeo e il tempo di guarigione delle ferite (Gyenis e altri 2005). Beheshtipour e altri (2012) hanno preso in considerazione l’aggiunta di microalghe allo yogurt probiotico sulla base delle sue caratteristiche chimiche, microbiologiche e sensoriali (Beheshtipour e altri 2012).
Composti funzionali arricchiti con batteri
Probiotici
I probiotici contengono almeno un ceppo probiotico vivente in grado di influire positivamente sulla salute dell’ospite, migliorando l’equilibrio microbico intestinale (Giboson e Roberfroid 1995; Biström e Nordström 2002). Le specie più comuni di batteri utilizzati nei prodotti lattiero-caseari probiotici sono L. acidophilus, L. johnsonii, L. gasseri, L. crispatus, L. casei, L. paracasei, L. rhamnosus, L. reuteri, L. plantarum, Bifidobacterium lactis, B. bifidum, B. infantis, B. breve, B. animalis e B. adolescentis (Kennedy e Bandaiphet 2004). Esistono diversi studi epidemiologici che sostengono il ruolo protettivo dei probiotici nei confronti dello sviluppo dei tumori (Commane e altri 2005). Il consumo di latticini fermentati con LAB potrebbe avere effetti antitumorali. Gli studi sugli effetti del consumo di probiotici sul cancro sembrerebbero essere promettenti, dato che recenti studi in vitro e in vivo hanno indicato come i batteri probiotici possano essere in grado di ridurre il rischio, l’incidenza e il numero di tumori del colon, del fegato, del seno e della vescica (de Moreno de LeBlanc e Perdigón 2010; Kumar e altri 2010a). L’effetto protettivo nei confronti dello sviluppo del cancro potrebbe essere attribuibile al legame dei mutageni da parte dei batteri intestinali (Kumar e altri 2010a; Kumar e altri 2012). I probiotici sono capaci di sopprimere la crescita dei batteri che convertono i composti procarcinogeni in composti cancerogeni e quindi di ridurre la quantità di agenti cancerogeni nell’intestino, facendo diminuire gli enzimi beta-glucuronidasi e beta-glucosidasi e la deconiugazione degli acidi biliari, oppure potenziando il sistema immunitario dell’ospite (de Moreno de LeBlanc e Perdigón 2010). Ci sono report secondo i quali la somministrazione di batteri lattici (LAB) comporta un aumento dell’attività degli enzimi antiossidanti o una modulazione dello stress ossidativo che proteggono le cellule dai danni indotti dagli agenti cancerogeni (Burns and Rowland 2000; Hirayama e Rafter 2000; Karimi e altri 2011; Kumar e altri 2011; Mohammadi e Mortazavian 2011). Un prodotto “simbiotico” contiene sia probiotici che prebiotici capaci di influire positivamente sulla salute dell’ospite, migliorando la sopravvivenza e/o l’attività dei batteri probiotici nel tratto gastroenterico (Kennedy e Bandaiphet 2004; Cruz e altri 2010). I possibili meccanismi tramite cui tali prodotti manifestano attività antitumorale includono: la capacità di variare il pH intestinale, di modulare la risposta immunitaria, di diminuire l’infiammazione a livello del colon, il possedere proprietà antimutagene e antiossidanti, e la capacità di produrre composti antitumorali e di ridurre i composti cancerogeni (Cho 2010).
Composti derivati dalla fermentazione
La fermentazione del latte può esercitare effetti preventivi sul cancro grazie alla presenza dei batteri delle colture starter o dei loro metaboliti. Il ruolo positivo delle colture starter viene significativamente aumentato quando si utilizzano i probiotici. I latticini fermentati contengono LAB vivi e questi batteri, insieme ai loro metaboliti, si sono dimostrati in grado di modulare la risposta immunitaria negli animali (Kato e altri 1994; Matsuzaki 1998; Kato e altri 1999), di sopprimere la carcinogenesi nei roditori (Kato e altri 1994; Lim e altri 2002), di inibire l’attività degli enzimi legati alla carcinogenesi (Spanhaak e altri 1998) e di legare le ammine mutagene e cancerogene eterocicliche (Knasmüller e altri 2001). Inoltre una componente importante del latte e dei prodotti lattiero-caseari, che eventualmente potrebbe mediare l’associazione con il rischio di cancro, è il lattosio. Il processo di fermentazione porta ad una diminuzione del contenuto di lattosio nel latte e ad un aumento del contenuto di acido lattico (Keszei e altri 2010). I peptidi bioattivi possono essere generati dalle colture starter utilizzate nella produzione di prodotti caseari fermentati. I sistemi proteolitici dei LAB, in particolare di Lactococcus lactis, Lactobacillus helveticus, e L. delbrueckii ssp. bulgaricus, sono ben definiti. Alcuni articoli hanno esaminato il rilascio dei vari peptidi bioattivi dalle proteine del latte dopo proteolisi batterica (Matar e altri 1996; Pihlanto-Leppälä e altri 1998). I peptidi bioattivi derivati dal latte comprendono antitrombotici (Bal dit Sollier e altri 1996), antipertensivi (Seppo e altri 2003), immunomodulatori (Laffineur e altri 1996), antiossidanti (Sandrine e altri 2001), antibatterici (Saito e altri 1994), antitumorali (Parodi 2007), carrier di minerali (Meisel e FitzGerald 2003) e sostanze promotori della crescita (Parodi 2007). Studi in vitro indicano che i peptidi derivati dalla caseina isolati dopo fermentazione microbica del latte, inibiscono lo sviluppo del cancro al colon alterando la cinetica cellulare (MacDonald e altri 1994). I risultati di un ampio studio prospettico condotto su donne e uomini svedesi hanno indicato che un elevato consumo di latte fermentato era correlato ad un rischio significativamente più basso di comparsa di cancro alla vescica. Le donne e gli uomini che consumavano ≥ 2 porzioni di latte fermentato al giorno avevano un rischio di comparsa di cancro alla vescica inferiore del 38% rispetto a quelli che non consumavano mai questa tipologia di latte (Larsson e altri 2008). I ceppi probiotici di E. faecium RM11 e L. fermentum RM28 hanno inoltre innescato la non-proliferazione delle cellule tumorali del colon a tassi che andavano, rispettivamente, dal 21% al 29% e dal 22% al 29% (Thirabunyanon e altri 2009). I risultati di un vasto studio caso-controllo giapponese sull’assunzione di LAB suggerivano che il consumo abituale di latte fermentato con il ceppo LcS riduceva il rischio di cancro alla vescica nella popolazione (Ohashi e altri 2002). Numerosi studi hanno riportato l’esistenza di una correlazione inversa tra il consumo di latte fermentato e il rischio di comparsa di varie tipologie di cancro come quello al colon, alla vescica, al fegato e al seno (Aso e Akazan 1992; Tomita e altri 1994; Aso e altri 1995; Lim e altri 2002; Radosavljević e altri 2003; Larsson e altri 2008; Rayes e altri 2008; Thirabunyanon e altri 2009; Keszei e altri 2010; Kumar e altri 2010a,b; Ahearn e altri 2011; Kumar e altri 2012). I LAB fermentano il lattosio del latte in acido lattico (con abbassamento del pH) e composti aromatici come acetaldeide e diacetile. L’anidride carbonica è tra gli altri possibili composti che vengono prodotti. I suddetti composti vanno ad inibire la crescita della maggior parte degli altri batteri presenti in un prodotto che viene considerato sicuro e nutriente. Il latte fermentato, e in particolare lo yogurt, sono ritenuti alimenti sicuri e nutrienti (Fonden e altri 2003). Il valido impatto del latte fermentato sulla prevenzione del cancro è rafforzato dalla presenza/aggiunta di probiotici batteri.
Effetti di latte e latticini sulla comparsa del cancro
Effetti degli ingredienti originariamente presenti nel latte sull’induzione del cancro
Cancro alla prostata. Una raccolta dei tassi relativi alla comparsa del cancro e dei dati sull’alimentazione di 42 paesi ha rivelato che il latte era l’alimento più strettamente correlato all’incidenza di questa tipologia di cancro (r = 0.711) e alla mortalità (r = 0.766) (Ganmaa e altri 2002). Un’analisi quantitativa degli studi di coorte pubblicati ha suggerito un aumento statisticamente significativo del 10% del rischio di cancro alla prostata dovuto al consumo di latte e di prodotti lattiero-caseari (Qin e altri 2007). Inoltre, una recente meta-analisi di studi prospettici ha riportato che gli uomini con un’assunzione di calcio maggiore, avevano un rischio di sviluppare un cancro alla prostata più alto del 39% rispetto a quelli con un’assunzione più bassa (Gao e altri 2005). Questi risultati suggeriscono come un consumo eccessivo di latte e latticini aumenti il rischio di comparsa del cancro alla prostata. Gao ed altri (2005) hanno quantificato un modello dose-risposta, stabilendo che, nei maschi adulti, il consumo di 3 porzioni al giorno di latticini era associato ad un aumento del 9% circa del rischio di comparsa del cancro alla prostata se confrontato con il consumo medio attuale (USA) di 1.8 porzioni al giorno (una porzione equivale a 244 g di latte o yogurt, 43 g di formaggio, 5 g di burro o 132 g di gelato) (Givens e altri 2008). I risultati di uno studio di coorte caso-controllo hanno mostrato che gli uomini che consumavano più di 2000 mg di calcio avevano un RR di 4.6 (IC 95% = 1.9-11.0) per il cancro alla prostata metastatico e mortale, rispetto agli uomini che ne consumavano meno di 500 mg (Giovannucci e altri 1998). Secondo alcuni autori il meccanismo alla base di tutto ciò era rappresentato dal fatto che un elevato apporto di calcio sopprimeva la conversione di 25(OH) vitamina D in 1,25(OH)2 vitamina D che possiede un effetto antitumorale nei confronti del cancro alla prostata (Veierød e altri 1997; Giovannucci 1998; Schuurman e altri 1999; Chan e altri 2000; Giovannucci e altri 2006; Li e altri 2007). È stato evidenziato che il grasso assunto con la dieta è in grado di far aumentare il livello di androgeni, che sono associati al rischio di cancro alla prostata (Dorgan e altri 1996; Fleshner e altri 2004). Inoltre, un elevato consumo di grasso animale è stato correlato ad un aumento dei livelli di testosterone (Dorgan e altri 1996) e questo può portare ad un aumento della divisione cellulare, all’attivazione di proto-oncogeni e all’inattivazione dei geni soppressori del tumore (Ross e Henderson 1994); quindi elevati livelli di testosterone possono influire sul rischio di comparsa del cancro alla prostata (Gann e altri 1996). I risultati di uno studio prospettico basato su una popolazione di 43435 uomini giapponesi, hanno evidenziato che specifici grassi saturi (acido miristico e acido palmitico) presenti nei latticini, farebbero aumentare il rischio di cancro alla prostata in modo dose-dipendente (Kurahashi e altri 2008). Tuttavia, un ampio studio prospettico condotto con un trial di screening del cancro alla prostata relativo ai prodotti caseari, ha mostrato che anche i latticini a basso contenuto di grassi potrebbero essere modestamente correlati ad un aumento del rischio di sviluppo del cancro alla prostata. Gli autori hanno ipotizzato che con la rimozione del grasso dal latte possano essere state rimosse altre componenti con proprietà potenzialmente anti-tumorali, come il CLA. Inoltre, il latte a basso contenuto di grassi contiene generalmente livelli più alti di calcio (Bodner-Montville e altri 2006) che, come detto sopra, possono incrementare il rischio di comparsa del cancro (Ahn e altri 2007). Le attuali linee guida dietetiche per la prevenzione del cancro incoraggiano il consumo consigliato di latte a basso contenuto di grassi o magro (Kushi e altri 2006). Le analisi di sottogruppo di prodotti lattiero-caseari come il latte intero, il latte magro, il latte scremato, il formaggio e lo yogurt hanno evidenziato che l’unica correlazione positiva significativa si aveva tra il consumo elevato di latte scremato e il rischio di cancro avanzato della prostata, con un RR di 1.23 (0.99-1.54) (Parodi 2009). Un certo numero di studi ha rilevato che un elevato consumo di latte scremato, ma non di latte intero, era correlato ad un aumento del rischio di cancro alla prostata (Parodi 2009). Gli androgeni e gli estrogeni vengono influenzati dall’assunzione dei grassi (Hill e altri 1980; Hämäläinen e altri 1984). Inoltre, va detto che il latte stesso contiene quantità considerevoli di estrogeni a causa del fatto che, nei paesi sviluppati, il latte in commercio è prodotto principalmente da vacche gravide. Poiché il 17β-estradiolo, un estrogeno, è considerato un agente cancerogeno per il tumore della prostata, il contenuto di estrogeni nel latte (potenziato dal grasso presente al suo interno) non dovrebbe essere ignorato quando si considera il latte come un fattore di rischio per il cancro alla prostata (Ganmaa e altri 2004; Qin e altri 2004a, b). Il latte vaccino contiene elevati livelli di IGF-I , che ha un ruolo importante nella regolazione della proliferazione cellulare, della differenziazione, dell’apoptosi e della trasformazione neoplastica (Jones e Clemmons 1995; Yu e Rohan 2000; Jerome e altri 2003; Pollak e altri 2004) e che può contribuire al rischio di comparsa del cancro alla prostata (Cadogan e altri 1997; Holmes e altri 2002; Renehan e altri 2004; Hoppe e altri 2006; Parodi 2009). In uno studio umano, la concentrazione di IGF-I nel plasma è aumentata del 10% dopo che soggetti sani hanno consumato latte vaccino (Heaney e altri 1999). Gli alti livelli di estrogeni e di IGF-I nel latte sono stati considerati responsabili di questo effetto (Qin e altri 2004b).
Cancro alle ovaie. I risultati di un esperimento condotto su una coorte svedese sottoposta a screening mammografico hanno mostrato l’esistenza di una correlazione tra il rischio di cancro alle ovaie e la quantità di latte consumata. Le donne che consumavano ≥ 4 porzioni di latte al giorno avevano un rischio doppio di sviluppare un cancro alle ovaie rispetto alle donne che consumavano < 2 porzioni al giorno. Analogamente, le donne che consumavano ≥ 2 bicchieri di latte al giorno avevano un rischio doppio di sviluppare un cancro alle ovaie rispetto alle donne che non lo bevevano mai o che lo bevevano raramente (Farlow e altri 2009). Inoltre, i risultati di una meta-analisi di studi di coorte hanno indicato un aumento dal 10% al 15% del rischio di cancro alle ovaie per ogni bicchiere di latte bevuto al giorno. Anche se questo risultato solleva preoccupazioni circa il possibile legame tra prodotti lattiero-caseari e cancro alle ovaie, sono comunque necessarie ulteriori ricerche. È stato ipotizzato che i latticini e alcune loro componenti (come il lattosio) siano in grado di promuovere un’eventuale carcinogenesi ovarica. Anche se studi caso-controllo hanno riportato risultati contrastanti per i latticini e il lattosio, diversi studi di coorte hanno mostrato l’esistenza di correlazioni positive tra il latte scremato, il lattosio e il cancro ovarico (Genkinger e altri 2006). Inoltre, i risultati di studi di caso-controllo hanno mostrato che il consumo di latte a basso contenuto di grassi era inversamente correlato al rischio di cancro alle ovaie mentre il consumo di latte intero era positivamente correlato a tale rischio (Larsson e altri 2006a). È stato proposto, sulla base di studi condotti su modelli animali e di studi ecologici, che il consumo (o il metabolismo) del lattosio potrebbe incrementare il rischio di comparsa del cancro alle ovaie (Larsson e altri 2006a). Esistono studi che suggeriscono l’esistenza di una correlazione positiva tra l’assunzione di lattosio e il rischio di cancro ovarico (Fairfield e altri 2004, Larsson e altri 2004). Il lattosio è un disaccaride che si trova solo nel latte e nei prodotti lattiero-caseari; viene scisso dalla lattasi intestinale per produrre galattosio e glucosio (Larsson e altri 2006a). Si pensa che il galattosio sia in grado di incrementare il rischio di comparsa del cancro ovarico vista la sua tossicità diretta nei confronti delle cellule germinali ovariche e grazie alla sua capacità di far aumentare i livelli di gonadotropina, che stimola la proliferazione dell’epitelio ovarico inducendo l’eventuale comparsa di una neoplasia ovarica (Harlow e altri 1991; Cramer e altri 1994). È possibile che l’elevato consumo di prodotti lattiero-caseari e, di conseguenza, di lattosio aumenti il rischio di sviluppo di cancro ovarico solo in alcuni sottogruppi della popolazione, come quelli con specifiche caratteristiche genetiche o biochimiche relative al metabolismo del galattosio (metabolita del lattosio) (Larsson e altri 2006a). Modelli animali hanno dimostrato che l’elevato galattosio alimentare provoca tossicità ovarica (Swartz e Mattison 1988; Reichardt e Woo 1991). Inoltre, l’ipogonadismo o l’insufficienza ovarica si verificano frequentemente tra le donne con galattosemia (Kaufman e altri 1981), che deriva da un difetto autosomico recessivo del gene della galattosio-1-fosfato uridil transferasi (GALT) (Larsson e altri 2006a). L’alterazione del gene GALT porterebbe ad un accumulo di galattosio e di altri metaboliti nell’organismo, comprese le ovaie (Larsson e altri 2006a). I risultati di un’analisi pooled di 12 studi di coorte mostravano che assunzioni di lattosio ≥ 30 rispetto a 10 g/d erano associate ad un più elevato rischio statisticamente significativo di cancro alle ovaie, anche se il trend non era statisticamente significativo (rischio relativo multivariato pooled, 1.19; intervallo di confidenza del 95%, 1.01 -1.40; P trend = 0.19) (Genkinger e altri 2006). Questo studio ha mostrato un modesto aumento del rischio di cancro ovarico per un consumo di lattosio equivalente a 3 o più porzioni di latte al giorno. I risultati di studi prospettici di coorte, ma non di studi caso-controllo, hanno rivelato che un consumo elevato di alimenti a base di latte e lattosio potrebbe aumentare il rischio di sviluppare un cancro alle ovaie (Larsson e altri 2006a).
Cancro al seno. Le principali ipotesi che suggeriscono un aumento del rischio di cancro al seno correlato al consumo di latticini sono le seguenti:
- Un elevato consumo di latticini può riflettere un elevato apporto complessivo di grassi alimentari, in particolare di grassi saturi, che, a loro volta, sono stati associati al rischio di cancro al seno. Il consumo di latticini totali non è stato correlato significativamente al rischio di cancro al seno, mentre un elevato consumo di grassi è stato correlato positivamente (Parodi 2005). Sebbene non tutti i latticini abbiano un elevato contenuto di grassi, un maggior consumo può essere associato ad un elevato apporto complessivo di grassi alimentari (Terry e altri 2001). Si è ipotizzato che il consumo di grassi totali aumenti il rischio di comparsa di un cancro al seno in quanto aumenta le concentrazioni di estrogeni circolanti, anche se le prove che lo dimostrano sono deboli (Holmes e altri 1999; Wu e altri 1999). Questa affermazione è stata supportata da dati provenienti da studi sperimentali condotti sui roditori e su linee cellulari (Welsch 1992). Anche se numerosi e recenti studi prospettici di coorte di grandi dimensioni hanno documentato l’esistenza di una correlazione positiva tra il consumo di grassi saturi e il cancro al seno (Thiébaut e altri 2007; Sieri e altri 2008), studi epidemiologici, e in particolare studi prospettici di coorte, non hanno dimostrato che i grassi alimentari sono in grado di incrementare il rischio di cancro al seno (Lee e Lin 2000).
- Presenza di composti organoclorurati. Sembra improbabile che la presenza occasionalmente elevata (ma legalmente consentita) di organoclorurati nei latticini possa essere collegata in maniera plausibile al cancro al seno (Moorman e Terry 2004).
- Il latte può contenere fattori di crescita, come l’IGF-I, che si sono dimostrati in grado di promuovere la crescita delle cellule tumorali del seno (Lu e altri 2001). Inoltre, gli esperimenti hanno dimostrato che l’IGF-I è probabilmente coinvolto nella trasformazione cellulare, poiché la rimozione o il blocco dei recettori per l’IGF-I della membrana cellulare impedisce la trasformazione maligna indotta da virus o oncogeni cellulari (Lu e altri 2001). Inoltre, gli estrogeni sono coinvolti nello sviluppo del cancro in quei siti ormone-dipendenti, come le ghiandole mammarie, le ovaie, l’endometrio e la prostata nei maschi (Parodi 2012). Le moderne vacche da latte geneticamente migliorate producono latte per quasi tutta la durata della gravidanza. Di conseguenza, il latte vaccino presente in commercio contiene elevati quantitativi di estrogeni e progesterone (Ganmaa e Sato 2005). I metaboliti degli estrogeni (EM) vengono considerati dei fattori di rischio per molteplici ragioni: a) un’aumentata esposizione agli EM porta ad una maggiore attività mitotica delle cellule endometriali, b) un’aumentata esposizione porta ad un aumento degli errori di replicazione del DNA e c) le mutazioni somatiche spesso portano ad un fenotipo maligno (Ganmaa e Sato2005; Yager e Davidson 2006; Farlow e altri 2009). Recenti studi hanno rivelato che il latte presente in commercio non contiene più di 5 pg/ml di estradiolo libero. L’estradiolo proveniente dai latticini viene ampiamente inattivato nel tratto gastroenterico e solo il 5% circa sopravvive dopo il primo passaggio al fegato (Parodi 2012). L’assunzione giornaliera prevista di estradiolo proveniente dai prodotti lattiero-caseari rappresenta, all’incirca, soltanto lo 0.25% in più dell’assunzione giornaliera accettabile stabilita da FAO/OMS per l’estradiolo esogeno. Dati i molteplici meccanismi che le cellule possiedono per ottenere l’estradiolo per la loro funzione, è molto improbabile che la piccola quantità di estradiolo esogeno fornito dai prodotti lattiero-caseari possa influenzare la carcinogenesi nei siti sensibili agli estrogeni (Parodi 2012).
Cancro alla vescica. La potenziale correlazione tra il consumo di latte o di prodotti lattiero-caseari e il rischio di cancro alla vescica è stata analizzata in diversi studi epidemiologici a partire dal 1980 (Li e altri 2011). Tuttavia, i risultati sono apparsi contraddittori e incongruenti (Li e altri 2011). I risultati provenienti da un ampio studio prospettico di coorte olandese hanno indicato l’esistenza di una correlazione positiva con il consumo di burro nelle donne a rischio di cancro alla vescica (Keszei e altri 2010). Mao e altri (2011) hanno riscontrato che il consumo di latte intero ad elevato contenuto di grassi era positivamente correlato al rischio di cancro alla vescica. Questo ci suggerisce l’esistenza del ruolo giocato dal grasso presente nel latte per quanto riguarda il rischio di cancro alla vescica. Tuttavia, ad oggi, non è stata riportata una valutazione completa sulla correlazione tra il consumo di latte o di latticini e il rischio di cancro alla vescica (Li e altri 2011). Pubblicazioni selezionate sulla comparsa del cancro dovuta al consumo di latte e prodotti da esso derivati sono elencate nella tabella 2.

Tabella 2. Pubblicazioni selezionate sull’induzione del cancro da parte di sostanze originarie presenti nel latte e nei latticini.
Effetti delle componenti esogene del latte sull’induzione del cancro
Contaminanti presenti nei latticini
Pesticidi. I residui di pesticidi nel latte possono derivare da una serie di potenziali fonti, tra cui quelle ambientali (acqua, suolo e aria), dalla contaminazione dei mangimi per gli animali (foraggio) o dagli animali da latte stessi poiché in allevamento vengono impiegate delle sostanze utili a proteggerli dai vettori di malattie (acari, zecche ed insetti). Le prime “pionieristiche” sostanze chimiche studiate a partire dagli anni ‘60 sono state gli organoclorurati (OC) come l’insetticida 1,1,1-tricloro-2,2-bis(4-clorofenil)etano (DDT) ed alcuni insetticidi organofosfati (OP). L’ingestione di questi composti potrebbe portare alla comparsa di alcuni tumori, tra cui il cancro al seno (Falck e altri 1992; Hunter e Kelsey 1993). Anche se l’impiego dei moderni pesticidi in agricoltura (sui vegetali e sui foraggi) non va a danneggiare praticamente gli animali e non comporta alcun rischio di avere residui significativi nel latte, una parte di questi residui (che sono ad oggi severamente regolamentati) potrebbe essere presente nel latte e nei latticini. I livelli di pesticidi OC, potenziali contaminanti del latte attraverso passaggio dall’ambiente, sono diminuiti negli ultimi dieci anni e si stanno compiendo sforzi a livello internazionale per ridurre ulteriormente la contaminazione ambientale (Fischer e altri 2011; Fuquay e Fox 2011). A questo proposito, la maggior parte dei paesi sviluppati ha stabilito livelli massimi di residui (LMR) di pesticidi nel latte e nei prodotti lattiero-caseari. Inoltre alcuni trattamenti termici, come la sterilizzazione e la pastorizzazione, si sono rivelati utili nel favorire una certa degradazione dei residui di pesticidi. I pesticidi OC sono liposolubili, quindi i loro residui si ritrovano prevalentemente nei latticini ad elevato contenuto di grassi come la panna e il burro. La diminuzione del quantitativo dei pesticidi nello yogurt può essere dovuta al trattamento termico a cui viene sottoposto il latte e all’attività dei batteri starter. Pertanto, in linea generale, il consumo di latticini potrebbe essere più sicuro di quello del latte crudo (Donia e altri 2010).
Farmaci veterinari. I farmaci antibiotici vengono somministrati agli animali per trattare le infezioni batteriche o a scopo profilattico per prevenire la diffusione di malattie, o per aumentare la crescita e la resa degli animali e dei prodotti da essi derivati. Tutti i farmaci somministrati agli animali si ritrovano nel latte entro certi limiti. I farmaci più frequentemente e comunemente utilizzati sono gli antibiotici, impiegati per combattere i patogeni causa di mastite e comprendono penicilline, cefalosporine, tetracicline, macrolidi, aminoglicosidi, chinoloni e polimixine. In linea generale, la preoccupazione dovuta al diffuso utilizzo di antimicrobici riguarda il potenziale sviluppo di ceppi patogeni antibiotico-resistenti che, in futuro, possono rendere più complicato il trattamento degli esseri umani. Inoltre, gli individui sensibili possono manifestare reazioni allergiche ai residui di antibiotici e/o ai loro metaboliti, come si è visto soprattutto per gli antibiotici B-lattamici (Bhandari e altri 2005; Fuquay e Fox 2011). L’utilizzo degli ormoni nell’allevamento degli animali può servire a diversi scopi, tra cui l’aumento della resa, il trattamento medico o il miglioramento dell’attività riproduttiva. È stato ipotizzato che i latticini che contengono ormoni (come l’IGF-I) potrebbero far aumentare il rischio di sviluppo del cancro al seno (Moorman e Terry 2004). Inoltre, alcune indagini hanno dimostrato che l’ormone della crescita bovina (BGH), che a volte viene somministrato ai bovini da latte per aumentare la produzione, provoca un aumento delle concentrazioni di IGF-I nel latte vaccino (Prosser e altri 1989; Outwater e altri 1997; Yu e Rohan 2000).
Melammina. La melammina, una molecola ad elevato contenuto di azoto, viene aggiunta illegalmente al latte diluito per far si che la lettura del contenuto proteico appaia elevata durante le misurazioni standard. È stata riportata la possibilità di un passaggio di melammina dal mangime che eventualmente la contiene al latte vaccino. Inoltre, la melammina è un metabolita minore del pesticida ciromazina ed è anche impiegata in alcuni fertilizzanti. Di conseguenza, bassi livelli di melammina possono migrare nel latte e nei latticini dal materiale a contatto con gli alimenti. L’obiettivo primario dell’azione tossica della melammina sono i reni e le vie urinarie. I livelli di melammina riportati nei latticini (compreso il latte artificiale) variavano da 0.09 a 6200 mg/kg (Fischer e altri 2011).
Micotossine. La contaminazione dei latticini con micotossine può avvenire tramite l’ingestione da parte degli animali da latte di mangimi infestati da funghi (ammuffiti). L’aflatossina M1 (AFM1) è il metabolita idrossilato dell’aflatossina B1 (AFB1) e si ritrova nel latte e successivamente in altri prodotti lattiero-caseari, quando gli animali in lattazione vengono alimentati con mangimi contaminati da muffe. I mammiferi che ingeriscono diete contaminate con aflatossina B1 (AFB1) espellono nel latte un certo quantitativo del principale metabolita 4-idrossilato, noto come aflatossina M1 (Prandini e altri 2009). Le aflatossine sono tossiche, cancerogene e/o teratogene per l’uomo e per gli animali. L’AFM1 è relativamente stabile sia nei latticini a latte crudo che in quelli lavorati, e non viene distrutta dai trattamenti termici standard, compresa la pastorizzazione. L’Agenzia Internazionale per la Ricerca sul Cancro (1994) ha classificato l’AFB1 come cancerogeno umano di classe 1 e l’AFM1 come possibile cancerogeno umano di classe 2B (Cathey e altri 1994; Galvano e altri 1996; Moss 2002). L’AFM1 è citotossica (come dimostrato in vitro negli epatociti umani) e la sua tossicità acuta nelle diverse specie è simile a quella dall’AFB1. L’AFM1 può anche causare danni al DNA, mutazioni geniche, anomalie cromosomiche e, in vitro, può indurre trasformazione cellulare nelle cellule di mammiferi, insetti, eucarioti inferiori e batteri (Prandini e altri 2009). Nel complesso, la presenza di AFM1 nel latte è particolarmente pericolosa per l’uomo, perché ha effetti sia cronici che acuti sulla salute umana. I sintomi acuti di un’intossicazione da aflatossine includono vomito, diarrea, febbre e dolore addominale. I sintomi cronici vengono correlati alla comparsa del cancro al fegato, all’epatite, all’ittero, all’epatomegalia e alla cirrosi (Turner e altri 2000). È stato riportato come le aflatossine possano giocare anche un ruolo nello sviluppo della sindrome di Reye, del kwashiorkor e nella soppressione del sistema immunitario che, a sua volta, aumenta l’incidenza di malattie (Scudamore 1998).
Altri contaminanti ambientali. Le diossine si formano come sottoprodotti accidentali durante molti processi chimici che coinvolgono il cloro e in qualsiasi processo di combustione. Le diossine sono sostanze tossiche molto potenti. I noti effetti tossici della diossina includono tossicità cutanea, immunotossicità, anomalie riproduttive, teratogenicità, alterazione del sistema endocrino e cancerogenicità. I latticini contribuiscono per 1/4-1/2 circa all’assunzione alimentare delle diossine totali (Bhandari e altri 2005). I policlorobifenili (PCB) sono idrocarburi clorurati e la loro produzione, lavorazione e distribuzione sono state vietate in quasi tutti i paesi industrializzati a partire dalla fine degli anni ‘80, ma il loro ingresso nell’ambiente può ancora avvenire, soprattutto a causa di pratiche di smaltimento improprie o di perdite da apparecchiature elettriche (come i trasformatori) e da sistemi idraulici ancora in uso. I PCB sono fonte di grande preoccupazione per la salute e possono avere una serie di effetti negativi. I PCB sono stati classificati come probabili agenti cancerogeni per l’uomo. Negli studi condotti sugli animali, i PCB hanno mostrato di avere effetti sulla sfera riproduttiva, sullo sviluppo e di essere tossici per il sistema immunitario. Pertanto, molti paesi hanno fissato dei limiti massimi per la presenza di residui di PCB nei latticini (Fischer e altri 2011). I metalli pesanti giungono nel latte tramite diverse vie. Elementi come il cromo e il nichel, provenienti da impianti di caseificazione in acciaio inossidabile, o lo stagno (materiale di cui sono fatte le lattine saldate), possono entrare nel latte per contatto diretto. I metalli pesanti come il cadmio, il piombo, il mercurio e l’arsenico non dovrebbero avere alcun contatto diretto con il latte e i prodotti lattiero-caseari, tranne che per cause accidentali. La principale via che permette a questi elementi di raggiungere il latte è l’ingestione da parte degli animali di mangimi ed acqua contaminati (Fischer e altri 2011). I risultati raccolti da studi precedenti hanno dimostrato che l’esposizione a lungo termine, anche a bassi livelli, all’arsenico inorganico è correlata ad un aumento del rischio di cancro dei polmoni, della pelle, della vescica ed eventualmente in altri siti. Inoltre, l’esposizione all’arsenico nella fase dello sviluppo può portare ad un aumento dello sviluppo del cancro al pancreas e del tumore ematopoietico (Yorifuji e altri 2010, 2011). Anche i nitrati/nitriti provengono da contaminazioni ambientali e possono essere presenti nel latte e nei prodotti lattiero-caseari. Solitamente il latte crudo contiene da 1 a 5 mg/L di nitrati e ≤ 0.01 mg/L di nitriti. La contaminazione post-secrezione con nitrati può avvenire durante la raccolta e la lavorazione del latte. Infatti l’acido nitrico può essere impiegato per disinfettare le attrezzature del caseificio e ciò può rendere possibile la contaminazione involontaria con NO3. L’altra fonte di contaminazione significativa è l’acqua di lavaggio in entrata o l’acqua che viene utilizzata per la ricostituzione delle polveri o quella aggiunta in altri prodotti. Pertanto, le moderne industrie si sono concentrate sulla purificazione dell’acqua tramite demineralizzazione. Inoltre, la contaminazione indiretta del latte liofilizzato con i nitrati è molto più probabile con gli essiccatori a spruzzo riscaldati piuttosto che con i sistemi riscaldati a vapore, poiché si formano prodotti derivati dalla combustione dei gas e responsabili della formazione di ossido nitrico. Inoltre, nella formulazione di alcuni formaggi, vengono aggiunte piccole quantità di nitrato (da 20 a 30 mg/kg di latte sfuso) per limitare la formazione tardiva dei buchi e la comparsa di difetti correlabili allo sviluppo di gas batterici. Tuttavia, il nitrato presente nel formaggio fresco è molto instabile e viene rapidamente ridotto a nitrito dalla xantina ossidasi del latte e da varie reduttasi microbiche durante la sua stagionatura. Pertanto, la sua presenza nel formaggio è solitamente molto bassa (Indyk e Woollard 2011). La maggior parte degli studi condotti in precedenza sulla correlazione tra nitrati e nitriti e il cancro umano si concentravano sui tumori del tratto gastroenterico, anche se appare biologicamente plausibile la correlazione con il rischio di cancro alla tiroide (Forman 1989; Boeing 1991; Van Loon e altri 1997). Recentemente, nell’Iowa Women’s Health Study, è stata riportata una correlazione positiva tra l’assunzione di nitrati e il cancro alla tiroide (Ward e altri 2010).
Composti che si formano durante il processo di lavorazione dei latticini
Durante la lavorazione del latte e dei prodotti lattiero-caseari, così come durante il periodo di conservazione, vengono prodotti o si modificano numerosi composti che potrebbero essere associabili alla comparsa di diverse tipologie di cancro. Le elevate temperature dell’industria lattiero-casearia e l’esposizione alla luce solare sono i due fattori più importanti che potrebbero indurre cambiamenti in alcuni ingredienti del latte (come proteine, grassi, carboidrati e vitamine) e favorire la formazione di composti potenzialmente cancerogeni e mutageni. Reazioni improprie come la pirolisi, l’ossidazione dei grassi e la reazione di Maillard possono essere notevolmente intensificate dalle elevate temperature. I latticini ad elevato contenuto di grassi e cremosi (come alcune tipologie di yogurt, formaggio e dessert) sono suscettibili all’auto-ossidazione e alla foto-ossidazione dei grassi, e tali reazioni di ossidazione possono portare alla formazione di radicali liberi e di composti polimerizzati cancerogeni (Belitz e altri 2004). Trattamenti termici con temperature importanti favoriscono l’ossidazione dei grassi. La reazione di Maillard, che si genera in seguito all’esposizione ad elevate temperature, ha notevoli conseguenze sulla qualità del latte e dei latticini in termini di colore, sapore, valore nutrizionale e di formazione di probabili composti tossici. Inoltre, alcuni prodotti della reazione di Maillard possono entrare a far parte di reazioni ossidative (van Boekel 1998). I trattamenti termici e l’omogeneizzazione del latte causano l’ossidazione del prezioso CLA antitumorale dopo esposizione ad elevate temperature, elevate pressioni e in seguito alla riduzione della dimensione dei globuli di grasso (Norgauer 2005). Nei prodotti caseari si ritrovano prodotti derivati dall’ossidazione del colesterolo (COP). I risultati pubblicati suggeriscono che il contenuto di COP nel latte e nei latticini è molto basso. La formazione dei COP nel latte e nei latticini avviene solo in particolari condizioni, come dopo l’applicazione di elevate temperature di riscaldamento per lunghi periodi o dopo una lunga conservazione ad elevate temperature e nel caso di alimenti disidratati o con basso contenuto di acqua. Inoltre, il latte in polvere contiene colesterolo ossidato, un prodotto che contribuisce ulteriormente allo stress ossidativo nei soggetti che lo consumano (Bösinger e altri 1993; Guardiola e altri 1996; Linseisen e Wolfram 1998; O’Brien e altri 2000). I COP possiedono molti effetti biologici negativi, sono infatti aterogeni (Imai e altri 1980), citotossici, mutageni (Sevanian e Peterson 1986) e cancerogeni (Sieber 2005).
Additivi nei latticini
Additivi come aromi, coloranti, dolcificanti, antiossidanti e conservanti antibatterici potrebbero avere effetti collaterali tossici quando superano le rispettive dosi giornaliere consentite (Fuquay e Fox 2011). Ad esempio, il blu brillante FCF, impiegato come colorante, può indurre il cancro, la comparsa di alcuni tumori maligni, l’asma e l’iperattività. La dose giornaliera accettabile (DGA) di blu brillante FCF è di 12.5 mg/kg p.c./giorno, valutata e stabilita in precedenza dal Joint FAO/OMS Expert Committee on Food Additives (JECFA 1970) e dall’EU Scientific Committee for food (SCF 1975). Nel 1984, secondo l’insieme di dati sull’assorbimento, sulla distribuzione, sul metabolismo, sull’escrezione, sulla genotossicità, sulla tossicità subcronica, a lungo termine, su quella per l’apparato riproduttore e per lo sviluppo, e secondo i dati sulla cancerogenicità, l’SCF ha corretto la DGA, che è passata a 10 mg/kg p.c./giorno (SCF 1984; EFSA 2010). Gli studi degli ultimi anni sulla somministrazione a lungo termine di carragenina (utilizzata come agente addensante), hanno dimostrato che può causare danni alla mucosa intestinale o lo sviluppo di colonie batteriche causa di ulcere, favorendo lo sviluppo e la crescita neoplastica. È necessario eseguire ulteriori ed essenziali studi epidemiologici per valutare la sicurezza della carragenina (Watanabe e altri 1978; Aihua 2009). Il consumo frequente di latticini aromatizzati contenenti saccarosio può far aumentare il rischio di cancro del colon-retto in seguito allo sviluppo di insulino-resistenza, che può essere associata alla comparsa di questa tipologia di cancro (Slattery e altri 1997) e alla comparsa di cancro al pancreas, dato che induce frequenti iperglicemie postprandiali, aumenta la domanda di insulina e ne diminuisce la sensibilità (Larsson e altri 2006b). Edulcoranti come la saccarina e l’aspartame vengono indicati come agenti cancerogeni (che colpiscono la vescica). Nello specifico vengono ritenuti coinvolti nello sviluppo del cancro alla vescica (Howe e altri 1977), ma la certezza del loro effetto cancerogeno è stata contestata quindi questi dolcificanti possono essere ancora utilizzati in molti paesi.
Conclusioni
Il latte e i latticini possono avere effetti sia positivi che negativi per quanto riguarda il rischio di comparsa di diverse tipologie di cancro. Le prove che indicano gli effetti positivi del consumo di latte e di latticini sulla prevenzione dei tumori sono notevolmente più numerose rispetto a quelle che riportano l’esistenza di effetti nocivi. Infatti, non esistono prove certe del fatto che il consumo di latte possa aumentare la mortalità per qualsiasi patologia. Gli occasional report sul probabile effetto causale del consumo di latte o latticini sulla comparsa di alcune tipologie di cancro (come quello della prostata) dimostrano l’esistenza di numerose prove convincenti, raccolte nell’arco di molti anni di consumo e riguardanti il loro indubbio impatto sulla salute e sul suo mantenimento, sulla sopravvivenza e sula longevità. Un esame attento e coscienzioso della letteratura in materia rivela però come il probabile effetto negativo del consumo di latte e latticini sullo sviluppo del cancro sia dose-dipendente. Pertanto, nelle persone in salute, la comparsa di un danno potrebbe verificarsi solamente in seguito ad un consumo assolutamente eccessivo ed indiscriminato e non come conseguenza di un consumo giornaliero regolare e moderato (come tra l’altro raccomandato dai nutrizionisti), mentre il reale problema per la salute umana sarebbe rappresentato dall’ingestione di quei prodotti gravemente (ed illegalmente) contaminati da inquinanti ambientali o contenenti determinate sostanze tossiche.
Riferimenti
Ahearn TU, McCullough ML, Flanders WD, Long Q, Sidelnikov E, Fedirko V, Daniel CR, Rutherford RE, Shaukat A, Bostick RM. 2011. A randomized clinical trial of the effects of supplemental calcium and vitamin D3 on markers of their metabolism in normal mucosa of colorectal adenoma patients. Cancer Res 71:413–23.
Ahn J, Albanes D, Peters U, Schatzkin A, Lim U, Freedman M, Chatterjee N, Andri le GL, Leitzmann MF, Hayes RB. 2007. Dairy products, calcium intake, and risk of prostate cancer in the prostate, lung, colorectal, and ovarian cancer screening trial. Cancer Epidemiol Biomarkers Prev 16:2623–30.
Ahonen MH, Zhuang YH, Aine R, Ylikomi T, Tuohimaa P. 2000. Androgen receptor and vitamin D receptor in human ovarian cancer: growth stimulation and inhibition by ligands. Int J Cancer 86:40–6.
Aihua AL. 2009. Advance on safety evaluation of carrageenan. Zhongguo Zhong Yao Za Zhi 34(5):512–4
Alvarez-Léon EE, Román-Vinas B, Serra-Majem L. 2006. Dairy products and health: a review of the epidemiological evidence. Br J Nutr 96:S94–9.
Aso Y, Akazan H. 1992. Prophylactic effect of a Lactobacillus casei preparation on the recurrence of superficial bladder cancer. BLP Study Group.Urol Intl 49:125–9.
Aso Y, Akaza H, Kotake T, Tsukamoto T, Imai K, Naito S. 1995. Preventive effect of a Lactobacillus casei preparation on the recurrence of superficial bladder cancer in a double-blind trial. The BLP Study Group. Eur Urol 27:104–9.
Aune D, Lau R, Chan D, Vieira R, Greenwood D, Kampman E, Norat T. 2012. Dairy products and colorectal cancer risk: a systematic review and meta-analysis of cohort studies. Ann Oncol 23:37–45.
Bal dit Sollier C, Drouet L, Pignaud G, Chevallier C, Caen J, Fiat AM, Izquierdo C, Jolles P. 1996. Effect of kappa-casein split peptides on platelet aggregation and on thrombus formation in the guinea-pig. Thromb Res 81:427–37.
Beheshtipour H, Mortazavian AM, Haratian P, Darani KK. 2012. Effects of Chlorella vulgaris and Spirulina platensis addition on the viability of probiotic bacteria in yogurt and its biochemical properties. Eur J Food Res Technol, DOI: 10.1007/s00217-012-1798-4.
Belitz H, Grosch W, Schieberle P. 2004. Food chemistry. Berlin, Germany: Springer.
Belobrajdic DP, McIntosh GH, Owens JA. 2003. Whey proteins protect more than red meat against azoxymethane-induced ACF in Wistar rats. Cancer Lett 198:43–51.
Bhandari SD, Schmidt RH, Rodrick GE. 2005. Hazards resulting from environmental, industrial, and agricultural contaminants. In: Food safety handbook. Hoboken, N.J.: John Wiley & Sons, Inc. p 291–321.
Bidoli E, La Vecchia C, Talamini R, Negri E, Parpinel M, Conti E, Montella M, Carbone A, Franceschi S. 2001. Micronutrients and ovarian cancer: a case-control study in Italy. Ann oncol 12:1589–93.
Biebinger R, Hurrell R, Ottaway P. 2008. Vitamin and mineral fortification of foods. In: Ottaway PB, editor. Food fortification and supplementation: technological, safety and regulatory aspects. Boca Raton, Fla.: CRC Press. P 27–40.
Bingham SA, Day N. 2006. Commentary: fat and breast cancer: time to re-evaluate both methods and results? Intl J Epidemiol 35:1022–4.
Biström M, Nordström K. 2002. Identification of key success factors of functional dairy foods product development. Trends Food Sci Technol 13:372–9.
Blumenfeld AJ, Fleshner N, Casselman B, Trachtenberg J. 2000. Nutritional aspects of prostate cancer: a review. Can J Urol 7:927–35; discussion 36.
Blutt SE, McDonnell TJ, Polek TC, Weigel NL. 2000. Calcitriol-induced apoptosis in LNCaP cells is blocked by overexpression of Bcl-2. Endocrinology 141:10–7.
Bodner-Montville J, Ahuja JKC, Ingwersen LA, Haggerty ES, Enns CW, Perloff BP. 2006. USDA food and nutrient database for dietary studies: released on the web. J Food Compos Anal 19:S100–7.
Boeing H. 1991. Epidemiological research in stomach cancer: progress over the last ten years. J Cancer Res Clin Oncol 117:133–43.
Boeneke C, Aryana K. 2007. Effect of folic acid fortification on the characteristics of yogurt. Milchwissenschaft 62:192–5.
Bösinger S, Luf W, Brandl E. 1993. Oxysterols: their occurrence and biological effects. Intl Dairy J 3:1–33.
Bounous G. 2000. Whey protein concentrate (WPC) and glutathione modulation in cancer treatment. Anticancer Res 20:4785–92.
Brommage R, Deluca HF. 1985. Evidence that 1, 25-dihydroxyvitamin D3 is the physiologically active metabolite of vitamin D3. Endocr Rev 6:491–511.
Burns A, Rowland I. 2000. Anti-carcinogenicity of probiotics and prebiotics. Curr Issues Intest Microbiol 1:13–24.
Cadogan J, Eastell R, Jones N, Barker ME. 1997. Milk intake and bone mineral acquisition in adolescent girls: randomised, controlled intervention trial. BMJ 315:1255–60.
Carpten J, Nupponen N, Isaacs S, Sood R, Robbins C, Xu J, Faruque M, Moses T, Ewing C, Gillanders E. 2002. Germline mutations in the ribonuclease L gene in families showing linkage with HPC1. Nat Genet 30:181–4.
Cathey C, Huang Z, Sarr A, Clement B, Phillips T. 1994. Development and evaluation of a minicolumn assay for the detection of aflatoxin M1 in milk. J Dairy Sci 77:1223–31.
Chan AT, Giovannucci EL. 2010. Primary prevention of colorectal cancer.
Gastroenterology 138:2029–43.
Chan JM, Pietinen P, Virtanen M, Malila N, Tangrea J, Albanes D, Virtamo J. 2000. Diet and prostate cancer risk in a cohort of smokers, with a specific focus on calcium and phosphorus (Finland). Cancer Causes Control 11:859–67.
Chan JM, Stampfer MJ, Giovannucci EL. 1998. What causes prostate cancer? A brief summary of the epidemiology. Semin Cancer Biol 8(4):263–73.
Chen P, Hu P, Xie D, Qin Y, Wang F, Wang H. 2010. Meta-analysis of vitamin D, calcium and the prevention of breast cancer. Breast Cancer Res Treat 121:469–77.
Cho E, Smith-Warner SA, Spiegelman D, Beeson WL, van den Brandt PA, Colditz GA, Folsom AR, Fraser GE, Freudenheim JL, Giovannucci E. 2004a. Dairy foods, calcium, and colorectal cancer: a pooled analysis of 10 cohort studies. J Natl Cancer Inst 96:1015–22.
Cho E, Smith-Warner SA, Spiegelman D, Beeson WL, van den Brandt PA, Colditz GA, Folsom AR, Fraser GE, Freudenheim JL, Giovannucci E, Goldbohm RA, Graham S, Miller AB, Pietinen P, Potter JD, Rohan TE, Terry P, Toniolo P, Virtanen MJ, Willett WC, Wolk A, Wu K, Yaun SS, Zeleniuch-Jacquotte A, Hunter DJ. 2004b. Dairy foods, calcium, and colorectal cancer: a pooled analysis of 10 cohort studies. J Natl Cancer Inst 96:1015–22.
Cho E, Spiegelman D, Hunter DJ, Chen WY, Stampfer MJ, Colditz GA, Willett WC. 2003. Premenopausal fat intake and risk of breast cancer. J Natl Cancer Inst 95:1079–85.
Cho SS. 2010. Handbook of prebiotics and probiotics ingredients: health benefits and food applications. Boca Raton, Fla.: CRC.
Commane D, Hughes R, Shortt C, Rowland I. 2005. The potential mechanisms involved in the anti-carcinogenic action of probiotics. Mutat Res/Fundam Mol Mech Mutagen 591:276–89.
Cox B, Sneyd MJ. 2011. School milk and risk of colorectal cancer: a national case-control study. Am J Epidemiol 173:394–403.
Cramer DW, Xu H, Sahi T. 1994. Adult hypolactasia, milk consumption, and age-specific fertility. Am J Epidemiol 139:282–9.
Cruz AG, Cadena RS, Walter EHM, Mortazavian AM, Granato D, Faria JAF, Bolini H. 2010. Sensory analysis: relevance for prebiotic, probiotic, and synbiotic product development. Compr Rev Food Sci Food Saf 9:358–73.
Cui Y, Rohan TE. 2006. Vitamin D, calcium, and breast cancer risk: a review. Cancer Epidemiol Biomarkers Prev 15:1427–37.
de Moreno de LeBlanc A, Perdigón G. 2010. The application of probiotic fermented milks in cancer and intestinal inflammation. Proc Nutr Soc 69:421–8.
Dong JY, Zhang L, He K, Qin LQ. 2011. Dairy consumption and risk of breast cancer: a meta-analysis of prospective cohort studies. Breast Cancer Res Treat 127:23–31.
Donia M, Abou-Arab A, Enb A, El-Senaity M, Abd-Rabou N. 2010. Chemical composition of raw milk and the accumulation of pesticide residues in milk products. Glob Vet 4:6–14.
Dorgan JF, Judd JT, Longcope C, Brown C, Schatzkin A, Clevidence BA, Campbell WS, Nair PP, Franz C, Kahle L. 1996. Effects of dietary fat and fiber on plasma and urine androgens and estrogens in men: a controlled feeding study. Am J Clin Nutr 64:850–5.
Duarte D, Nicolau A, Teixeira J, Rodrigues L. 2011. The effect of bovine milk lactoferrin on human breast cancer cell lines. J Dairy Sci 94:66–76.
European Food Safety Authority (EFSA). 2010. Scientific Opinion on the re-evaluation of Brilliant Blue FCF (E 133) as a food additive. EFSA Panel on Food Additives and Nutrient Sources added to Food. EFSA J 8 (11): 1853; 1–36.
Eliassen LT, Berge G, Sveinbjornsson B, Svendsen JS, Vorland LH, Rekdal O. 2002. Evidence for a direct antitumor mechanism of action of bovine lactoferricin. Anticancer Res 22:2703–10.
Elwood PC, Givens DI, Beswick AD, Fehily AM, Pickering JE, Gallacher J. 2008. The survival advantage of milk and dairy consumption: an overview of evidence from cohort studies of vascular diseases, diabetes and cancer. J Am Coll Nutr 27:723S–34S.
Fairfield KM, Hunter DJ, Colditz GA, Fuchs CS, Cramer DW, Speizer FE, Willett WC, Hankinson SE. 2004. A prospective study of dietary lactose and ovarian cancer. Intl J Cancer 110:271–7.
Falck Jr. F, Ricci Jr. A, Wolff MS, Godbold J, Deckers P. 1992. Pesticides and polychlorinated biphenyl residues in human breast lipids and their relation to breast ca cer. Arch Environ Health 47:143–6.
Farlow DW, Xu X, Veenstra TD. 2009. Quantitative measurement of endogenous estrogen metabolites, risk-factors for development of breast cancer, in commercial milk products by LC-MS/MS. Chromatogr B Anal Technol Biomed Life Sci 877(13):1327–34.
Fedirko V, Bostick RM, Flanders WD, Long Q, Sidelnikov E, Shaukat A, Daniel CR, Rutherford RE, Woodard JJ. 2009. Effects of vitamin d and calcium on proliferation and differentiation in normal colon mucosa: a randomized clinical trial. Cancer Epidemiol Biomarkers Prev 18: 2933–41.
Ferlay J, Shin HR, Bray F, Forman D, Mathers C, Parkin DM. 2010. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008. Intl J Cancer 127:2893–917.
Fischer WJ, Schilter B, Tritscher AM, Stadler RH. 2011. Contaminants of milk and dairy products. In: Contamination resulting from farm and dairy practices: encyclopedia of dairy sciences. 2nd ed. San Diego: Academic Press. P 887–97.
Fleshner N, Bagnell PS, Klotz L, Venkateswaran V. 2004. Dietary fat and prostate cancer. J Urol 171:S19–24.
Fonden R, Saarela M, Matto J, Mattila-Sandholm T. 2003. Lactic acid bacteria (LAB) in functional dairy products. Funct Dairy Prod 1:244–57.
Forman D. 1989. Are nitrates a significant risk factor in human cancer?
Cancer Surv 8(2):443–58.
Friedrich M, Rafi L, Mitschele T, Tilgen W, Schmidt W, Reichrath J. 2003. Analysis of the vitamin D system in cervical carcinomas, breast cancer and ovarian cancer. Recent Results Cancer Res 164:239–46.
Fuquay JW, Fox PF. 2011. Encyclopedia of dairy sciences. 2nd ed., vol. 1. U.K.: Academic Press. P 3–60.
Galvano F, Galofaro V, Galvano G. 1996. Occurrence and stability of aflatoxin M1 in milk and milk products: a worldwide review. J Food Protect 59(10):1079–90.
Gangadharan D, Nampoothiri KM. 2011. Folate production using Lactococcus lactis ssp cremoris with implications for fortification of skim milk and fruit juices. LWT-Food Sci Technol 44:1859–64.
Ganmaa D, Li XM, Wang J, Qin LQ, Wang PY, Sato A. 2002. Incidence and mortality of testicular and prostatic cancers in relation to world dietary practices. Intl J Cancer 98:262–7.
Ganmaa D, Qin LQ, Wang PY, Tezuka H, Teramoto S, Sato A. 2004. A two-gener tion reproduction study to assess the effects of cows’ milk on reproductive development in male and female rats. Fertil Steril 82:1106–14.
Ganmaa D, Sato A. 2005. The possible role of female sex hormones in milk from pregnant cows in the development of breast, ovarian and corpus uteri cancers. Med Hypotheses 65:1028–37.
Gann PH, Hennekens CH, Ma J, Longcope C, Stampfer MJ. 1996. Prospective study of sex hormone levels and risk of prostate cancer. J Natl Cancer Inst 88:1118–26.
Gao X, LaValley MP, Tucker KL. 2005. Prospective studies of dairy product and calcium intakes and prostate cancer risk: a meta-analysis. J Natl Cancer Inst 97:1768–77.
Genkinger JM, Hunter DJ, Spiegelman D, Anderson KE, Arslan A, Beeson WL, Buring JE, Fraser GE, Freudenheim JL, Goldbohm RA. 2006. Dairy products and ovarian cancer: a pooled analysis of 12 cohort studies. Cancer Epidemiol Biomarkers Prev 15:364–72.
Gibson GR, Roberfroid MB. 1995. Dietary modulation of the human colonic microbiota: introducing the concept of prebiotics. J Nutr 125:1401–12.
Giovannucci E. 1998. Dietary influences of 1, 25 (OH)2 vitamin D in relation to prostate cancer: a hypothesis. Cancer Cause Control 9:567–82.
Giovannucci E. 2005. The epidemiology of vitamin D and cancer incidence and mortality: a review (United States). Cancer Cause Control 16:83–95.
Giovannucci E, Liu Y, Rimm EB, Hollis BW, Fuchs CS, Stampfer MJ, Willett WC. 2006. Prospective study of predictors of vitamin D status and cancer incidence and mortality in men. J Natl Cancer Inst 98:451–9.
Giovannucci E, Rimm EB, Wolk A, Ascherio A, Stampfer MJ, Colditz GA, Willett WC. 1998. Calcium and fructose intake in relation to risk of prostate cancer. Cancer Res 58:442–7.
Givens D, Morgan R, Elwood P. 2008. Relationship between milk consumption and prostate cancer: a short review. Nutr Bull 33:279–86.
Goeptar AR, Koeman JH, van Boekel MAJS, Alink GM. 1997. Impact of digestion on the antimutagenic activity of the milk protein casein. Nutr Res 17:1363–79.
Gonzalez CA, Riboli E. 2010. Diet and cancer prevention: contributions from the European Prospective Investigation into Cancer and Nutrition (EPIC) study. Eur J Cancer 46:2555–62.
Goodman MT, Wu AH, Tung KH, McDuffie K, Kolonel LN, Nomura AMY, Terada K, Wilkens LR, Murphy S, Hankin JH. 2002. Association of dairy products, lactose, and calcium with the risk of ovarian cancer. Am J Epidemiol 156:148–57.
Govers M, van der Meet R. 1993. Effects of dietary calcium and phosphate on the intestinal interactions between calcium, phosphate, fatty acids, and bile acids. Gut 34:365–70.
Grant WB. 2003. Ecologic studies of solar UV-B radiation and cancer mortality rates. Recent Results Cancer Res 371–8.
Grant WB. 2007. An ecologic study of cancer mortality rates in Spain with respect to indices of solar UVB irradiance and smoking. Intl J Cancer 120:1123–8.
Greenlee RT, Murray T, Bolden S, Wingo PA. 2000. Cancer statistics, 2000. CA-Cancer J Clin 50:7–33.
Guardiola F, Codony R, Addis P, Rafecas M, Boatella J. 1996. Biological effects of oxysterols: current status. Food Chem Toxicol 34:193–211.
Gyenis B, Szigeti J, Molnár N, Varga L. 2005. Use of dried microalgal biomasses to stimulate acid production and growth of Lactobacillus plantarum and Enterococcus faecium in milk. Acta Agraria Kaposváriensis 9:53–9.
Hague A, Paraskeva C. 1995. The short-chain fatty acid butyrate induces apoptosis in colorectal tumour cell lines. Eur J Cancer Prev 4:359–64.
Hakkak R, Korourian S, Ronis MJJ, Johnston JM, Badger TM. 2001. Dietary whey protein protects against azoxymethane-induced colon tumors in male rats. Cancer Epidemiol Biomarkers Prev 10:555–8.
Hämäläinen E, Adlercreutz H, Puska P, Pietinen P. 1984. Diet and serum sex hormones in healthy men. J Steroid Biochem 20:459–64.
Harlow BL, Cramer DW, Geller J, Willett WC, Bell DA, Welch WR. 1991. The influence of lactose consumption on the association of oral contraceptive use and ovarian cancer risk. Am J Epidemiol 134:445–53.
Heaney RP, McCarron DA, Dawson-Hughes B, Oparil S, Berga SL, Stern JS, Barr SI, Rosen CJ. 1999. Dietary changes favorably affect bone remodeling in older adults. J Am Diet Assoc 99:1228–33.
Heydari S, Mortazavian AM, Ehsani MR, Mohammadifar MA, Ezzatpanah, H. 2011. Biochemical, microbiological and sensory characteristics of probiotic yogurt containing various prebiotic compounds. Ital J Food Sci 23:153–63.
Hill P, Wynder EL, Garnes H, Walker A. 1980. Environmental factors, hormone st tus, and prostatic cancer. Prev Med 9:657–66.
Hirayama K, Rafter J. 2000. The role of probiotic bacteria in cancer prevention. Microbes Infect 2:681–6.
Hjartåker A, Thoresen M, Engeset D, Lund E. 2010. Dairy consumption and calcium intake and risk of breast cancer in a prospective cohort: The Norwegian women and cancer study. Cancer Cause Control 21:1875–85.
Holick MF. 2008. Vitamin D and sunlight: strategies for cancer prevention and other health benefits. Clin J Am Soc Nephrol 3:1548–54.
Holmes MD, Pollak MN, Willett WC, Hankinson SE. 2002. Dietary correlates of plasma insulin-like growth factor I and insulin-like growth factor binding protein 3 concentrations. Cancer Epidemiol Biomarkers Prev 11:852–61.
Holmes MD, Schisterman EF, Spiegelman D, Hunter DJ, Willett WC. 1999. Re: meta-analysis: dietary fat intake, serum estrogen levels, and the risk of breast cancer. J Natl Cancer Inst 91:1511–2.
Holt PR. 2008. New insights into calcium, dairy and colon cancer. World J Gastroenterol 14:4429–33.
Holt PR, Atillasoy EO, Gilman J, Guss J, Moss SF, Newmark H, Fan K, Yang K, Lipkin M. 1998. Modulation of abnormal colonic epithelial cell proliferation and differentiation by low-fat dairy foods: a randomized controlled trial. JAMA 280:1074–9.
Holt PR, Wolper C, Moss SF, Yang K, Lipkin M. 2001. Comparison of calcium su plementation or low-fat dairy foods on epithelial cell proliferation and differentiation. Nutr Cancer 41:150–5.
Hoppe C, Mølgaard C, Michaelsen KF. 2006. Cow’s milk and linear growth in industrialized and developing countries. Annu Rev Nutr 26: 131–73.
Howe G, Burch J, Miller A, Morrison B, Gordon P, Weldon L, Chambers L, Fodor G, Winsor G. 1977. Artificial sweeteners and human bladder cancer. Lancet 310:578–81.
Hunter DJ, Kelsey KT. 1993. Pesticide residues and breast cancer: the harvest of a silent spring? J Natl Cancer Inst 85:598–9.
Iigo M, Alexander DB, Long N, Xu J, Fukamachi K, Futakuchi M, Takase M, Tsuda H. 2009. Anticarcinogenesis pathways activated by bovine lactoferrin in the murine small intestine. Biochimie 91:86–101.
Imai H, Werthessen NT, Subramanyam V, Lequesne PW, Soloway AH, Kanisawa M. 1980. Angiotoxicity of oxygenated sterols and possible precursors. Science 207:651–3.
Indyk HE, Woollard DC. 2011. Contaminants of milk and dairy products: nitrates and nitrites as contaminants. In: Fuquay JW, editor-in chief. Encyclopedia of dairy sciences. 2nd ed. San Diego: Academic Press. P 906–11.
Jankevicius F, Miller S, Ackermann R. 2002. Nutrition and risk of prostate cancer. Urol Intl 68:69–80.
JECFA (Joint FAO/WHO Expert Committee on Food Additives). 1970. Toxicological evaluation of some food colours, emulsifiers, stabilizers, anticaking agents, and certain other substances. 13th Report, WHO Food Additives Series 70.36.
Jelen P. 2005. In: Shortt C, O’Brien J, editors. Handbook of functional dairy products. Boca Raton, Fla: CRC Press.
Jemal A, Tiwari RC, Murray T, Ghafoor A, Samuels A, Ward E, Feuer EJ, Thun MJ. 2004. Cancer statistics, 2004. Cancer J Clin 54:8–29.
Jerome L, Shiry L, Leyland-Jones B. 2003. Deregulation of the IGF axis in cancer: epidemiological evidence and potential therapeutic interventions. Endocr Relat Cancer 10:561–78.
Jiang F, Bao J, Li P, Nicosia SV, Bai W. 2004. Induction of ovarian cancer cell apoptosis by 1, 25-dihydroxyvitamin D3 through the down-regulation of telomerase. J Biol Chem 279:53213–21.
Jones EL, Shingfield KJ, Kohen C, Jones AK, Lupoli B, Grandison AS, Beever DE, Williams CM, Calder PC, Yaqoob P. 2005. Chemical, physical, and sensory properties of dairy products enriched with conjugated linoleic acid. J Dairy Sci 88:2923–37.
Jones JI, Clemmons DR. 1995. Insulin-like growth factors and their binding proteins: biological actions. Endocr Rev 16:3–34.
Kahraman O, Ustunol Z. 2012. Effect of zinc fortification on Cheddar cheese quality. J Dairy Sci 95:2840–7.
Karagas MR, Tosteson TD, Greenberg ER, Rothstein RI, Roebuck BD, Herrin M, Ahnen D. 1998. Effects of milk and milk products on rectal mucosal cell proliferation in humans. Cancer Epidemiol Biomarkers Prev 7:757–66.
Karimi R, Mortazavian A, Da Cruz A. 2011. Viability of probiotic microorganisms in cheese during production and storage: a review. Dairy Sci Technol 91:283–308.
Kato I, Endo K, Yokokura T. 1994. Effects of oral administration of Lactobacillus casei on antitumor responses induced by tumor resection in mice. Intl J Immunopharmacol 16:29–36.
Kato I, Tanaka K, Yokokura T. 1999. Lactic acid bacterium potently induces the production of interleukin-12 and interferon-[gamma] by mouse splenocytes. Intl J Immunopharmaco 21:121–31.
Kaufman FR, Kogut MD, Donnell GN, Goebelsmann U, March C, Koch R. 1981. Hypergonadotropic hypogonadism in female patients with galactosemia. N Engl J Med 304:994–8.
Kazmi SA, Vieth R, Rousseau D. 2007. Vitamin D3 fortification and quantification in processed dairy products. Intl Dairy J 17:753–9.
Kelley NS, Hubbard NE, Erickson KL. 2007. Conjugated linoleic acid isomers and cancer. J Nutr 137:2599–607.
Kennedy JF, Bandaiphet C. 2004. Carbohydrate polymers: functional dairy products. In: Mattila-Sandholm T, Saarela M, editors. Cambridge, U.K.: Woodhead Publishing Limited. P 395.
Kent K, Harper W, Bomser J. 2003. Effect of whey protein isolate on intracellular glutathione and oxidant-induced cell death in human prostate epithelial cells. Toxicol In Vitro 17:27–33.
Keszei AP, Schouten LJ, Goldbohm RA, van den Brandt PA. 2010. Dairy intake and the risk of bladder cancer in the Netherlands Cohort Study on Diet and Cancer. Am J Epidemiol 171:436–46.
Klein EA. 2005. Chemoprevention of prostate cancer. Crit Rev Oncol Hematol 54:1–10.
Knasmüller S, Steinkellner H, Hirschl AM, Rabot S, Nobis EC, Kassie F. 2001. I pact of bacteria in dairy products and of the intestinal microflora on the genotoxic and carcinogenic effects of heterocyclic aromatic amines. Mutat Res Fundam Mol Mech Mutagen 480:129–38.
Knekt P, Järvinen R, Seppänen R, Pukkala E, Aromaa A. 1996. Intake of dairy products and the risk of breast cancer. Br J Cancer 73:687–91.
Koralek DO, Bertone-Johnson ER, Leitzmann MF, Sturgeon SR, Lacey Jr. JV, Schairer C, Schatzkin A. 2006. Relationship between calcium, lactose, vitamin D, and dairy products and ovarian cancer. Nutr Cancer 56:22–30.
Kumar A, Singh NK, Sinha PR, Kumar R. 2010b. Intervention of Acidophilus casei dahi and wheat bran against molecular alteration in colon carcinogenesis. Mol Biol Rep 37:621–7.
Kumar M, Kumar A, Nagpal R, Mohania D, Behare P, Verma V, Kumar P, Poddar D, Aggarwal P, Henry C. 2010a. Cancer-preventing attributes of probiotics: an update. Int J Food Sci Nutr 61:473–96.
Kumar M, Verma V, Nagpal R, Kumar A, Behare P, Singh B, Aggarwal P. 2012. Anticarcinogenic effect of probiotic fermented milk and chlorophyllin on aflatoxin-B1-induced liver carcinogenesis in rats. Brit J Nutr 107(7):1006–16.
Kumar M, Verma V, Nagpal R, Kumar A, Gautam SK, Behare PV, Grover CR, Aggarwal PK. 2011. Effect of probiotic fermented milk and chlorophyllin on gene expressions and genotoxicity during AFB-induced hepatocellular carcinoma. Gene 490:54–9.
Kurahashi N, Inoue M, Iwasaki M, Sasazuki S, Tsugane S. 2008. Dairy product, sat rated fatty acid, and calcium intake and prostate cancer in a prospective cohort of Japanese men. Cancer Epidemiol Biomarkers Prev 17:930–7.
Kushi LH, Byers T, Doyle C, Bandera EV, McCullough M, Gansler T, Andrews KS, Thun MJ. 2006. American Cancer Society guidelines on nutrition and physical activity for cancer prevention: reducing the risk of cancer with healthy food choices and physical activity. Cancer J Clin 56:254–81.
Kushi LH, Mink PJ, Folsom AR, Anderson KE, Zheng W, Lazovich DA, Sellers TA. 1999. Prospective study of diet and ovarian cancer. Am J Epidemiol 149:21–31.
La Vecchia C, Negri E, D’Avanzo B, Boyle P, Franceschi S. 1991. Dietary indicators of oral and pharyngeal cancer. Intl J Epidemiol 20:39–44.
Laakkonen A, Pukkala E. 2008. Cancer incidence among Finnish farmers, 1995–2005. Scand J Work Environ Health 34:73–9.
Laffineur E, Genetet N, Leonil J. 1996. Immunomodulatory activity of beta-casein permeate medium fermented by lactic acid bacteria. J Dairy Sci 79:2112–20.
Lampe JW. 2011. Dairy products and cancer. J Am Coll Nutr 30:464S–70S.
Lamprecht SA, Lipkin M. 2001. Cellular mechanisms of calcium and vitamin D in the inhibition of colorectal carcinogenesis. Ann N Y Acad Sci 952:73–87.
Larsson SC, Andersson SO, Johansson JE, Wolk A. 2008. Cultured milk, yogurt, and dairy intake in relation to bladder cancer risk in a prospective study of Swedish women and men. Am J Clin Nutr 88:1083–7.
Larsson SC, Bergkvist L, Wolk A. 2004. Milk and lactose intakes and ovarian cancer risk in the Swedish Mammography Cohort. Am J Clin Nutr 80:1353–7.
Larsson SC, Bergkvist L, Wolk A. 2005. High-fat dairy food and conjugated linoleic acid intakes in relation to colorectal cancer incidence in the Swedish mammography cohort. Am J Clin Nutr 82:894–900.
Larsson SC, Bergkvist L, Wolk A. 2006a. Consumption of sugar and sugar-sweetened foods and the risk of pancreatic cancer in a prospective study. Am J Clin Nutr 84:1171–6.
Larsson SC, Orsini N, Wolk A. 2006a. Milk, milk products and lactose intake and ovarian cancer risk: a meta-analysis of epidemiological studies. Intl J Cancer 118:431–41.
Lee MM, Lin SS. 2000. Dietary fat and breast cancer. Annu Rev Nutr 20:221–48.
Lefkowitz ES, Garland CF. 1994. Sunlight, vitamin D, and ovarian cancer mortality rates in US women. Intl J Epidemiol 23:1133–6.
Li F, An S, Zhou Y, Liang Z, Jiao Z, Jing Y, Wan P, Shi X, Tan W. 2011. Milk and dairy consumption and risk of bladder cancer: a meta-analysis. Urology 78:1298–305.
Li H, Stampfer MJ, Hollis JBW, Mucci LA, Gaziano JM, Hunter D, Giovannucci EL, Ma J. 2007. A prospective study of plasma vitamin D metabolites, vitamin D receptor polymorphisms, and prostate cancer. PloS Med 4(3):e103.
Liew C, Schut HA, Chin SF, Pariza MW, Dashwood RH. 1995. Protection of conjugated linoleic acids against 2-amino-3- methylimidazo[4,5-f] quinoline-induced colon carcinogenesis in the F344 rat: a study of inhibitory mechanisms. Carcinogenesis 16:3037–43.
Lim BK, Mahendran R, Lee YK, Bay BH. 2002. Chemopreventive effect of Lactobacilus rhamnosus on growth of a subcutaneously implanted bladder cancer cell line in the Mouse. Cancer Sci 93:36–41.
Linseisen J, Wolfram G. 1998. Origin, metabolism, and adverse health effects of cholesterol oxidation products. Lipid/Fett 100:211–8.
Llor X, Jacoby RF, Teng BB, Davidson NO, Sitrin MD, Brasitus TA. 1991. K-ras mutations in 1, 2-dimethylhydrazine-induced colonic tumors: effects of supplemental dietary calcium and vitamin D deficiency. Cancer Res 51:4305–9.
Lokeshwar BL, Schwartz GG, Selzer MG, Burnstein KL, Zhuang SH, Block NL, Binderup L. 1999. Inhibition of prostate cancer metastasis in vivo: a comparison of 1, 25-dihydroxyvitamin D (calcitriol) and EB1089. Cancer Epidemiol Biomarkers Prev 8:241–8.
Lu Y, Zi X, Zhao Y, Mascarenhas D, Pollak M. 2001. Insulin-like growth factor-I receptor signaling and resistance to trastuzumab (Herceptin). J Natl Cancer Inst 93:1852–7.
MacDonald RS, Thornton WH, Marshall RT. 1994. A cell culture model to identify biologically active peptides generated by bacterial hydrolysis of casein. J Dairy Sci 77:1167–75.
Mao QQ, Dai Y, Lin YW, Qin J, Xie LP, Zheng XY. 2011. Milk consumption and bladder cancer risk: A meta-analysis of published epidemiological studies. Nutr Cancer 63:1263–71.
Marmot M, Atinmo T, Byers T, Chen J, Hirohata T, Jackson A, James W, Kolonel L, Kumanyika S, Leitzmann C. 2007. Food, nutrition, physical activity, and the prevention of cancer: a global perspective. Washington, DC: AICR. P 46.
Marshall NK. 2004. Therapeutic applications of whey protein. Altern Med Rev 9:136–56.
Matar C, Amiot J, Savoie L, Goulet J. 1996. The effect of milk fermentation by Lactobacillus helveticus on the release of peptides during in vitro digestion. J Dairy Sci 79:971–9.
Matsuzaki T. 1998. Immunomodulation by treatment with Lactobacillus casei strain Shirota. Intl J Food Microbiol 41:133–40.
McCann SE, Ip C, Ip MM, McGuire MK, Muti P, Edge SB, Trevisan M, Freudenheim JL. 2004. Dietary intake of conjugated linoleic acids and risk of premenopausal and postmenopausal breast cancer, Western New York Exposures and Breast Cancer Study (WEB Study). Cancer Epidemiol Biomarkers Prev 13:1480–4.
McCarron DA, Heaney RP. 2004. Estimated healthcare savings associated with ad quate dairy food intake. Am J Hypertens 17:88–97.
McConkey DJ, Orrenius S. 1997. The role of calcium in the regulation of apoptosis. Biochem Biophys Res Commun 239:357–66.
McCullough ML, Rodriguez C, Diver WR, Feigelson HS, Stevens VL, Thun MJ, Calle EE. 2005. Dairy, calcium, and vitamin D intake and postmenopausal breast cancer risk in the Cancer Prevention Study II Nutrition Cohort. Cancer Epidemiol Biomarkers Prev 14:2898–904.
McIntosh GH, Le Leu RK. 2001. The influence of dietary proteins on colon cancer risk. Nutr Res 21:1053–66.
McIntosh GH, Regester GO, Le Leu RK, Royle PJ, Smithers GW. 1995. Dairy proteins protect against dimethylhydrazine-induced intestinal cancers in rats. J Nutr 125:809–16.
McIntosh GH, Royle PJ, Le Leu RK, Regester GO, Johnson MA, Grinsted RL, Kenward RS, Smithers GW. 1998. Whey proteins as functional food ingredients? Intl Dairy J 8:425–34.
Meisel H, FitzGerald R. 2003. Biofunctional peptides from milk proteins: mineral binding and cytomodulatory effects. Curr Pharm Des 9: 1289–96.
Micke P, Beeh K, Schlaak J, Buhl R. 2001. Oral supplementation with whey proteins increases plasma glutathione levels of HIV-infected patients. Eur J Clin Invest 31:171–8.
Miller GD, Jarvis JK, McBean LD. 2007. Handbook of dairy foods and nutrition. Boca Raton, Fla.: CRC. P 1.
Mizoue T, Kimura Y, Toyomura K, Nagano J, Kono S, Mibu R, Tanaka M, Kakeji Y, Maehara Y, Okamura T, Ikejiri K, Futami K, Yasunami Y, Maekawa T, Takenaka K, Ichimiya H, Imaizumi N. 2008. Calcium, dairy foods, vitamin D, and colorectal cancer risk: the Fukuoka colorectal cancer study. Cancer Epidemiol Biomarkers Prev 17:2800–7.
Mohamadi R, Mortazavian AM. 2010. Technological aspects of prebiotics in probiotic fermented milks. Food Rev Intl 27:192–212.
Mohammadi R, Mortazavian A. 2011. Review article: technological aspects of prebiotics in probiotic fermented milks. Food Rev Intl 27:192–212.
Mohammadi R, Mortazavian AM, Khosrokhavar R, da Cruz AG. 2011. Probiotic ice cream: viability of probiotic bacteria and sensory properties. Ann Microbiol 61:411–24.
Mohammadi R, Sohrabvandi S, Mortazavian AM. 2012. The starter culture characteristics of probiotic microorganisms in fermented milks. Eng Life Sci 12(4):399–409.
Mommers M, Schouten LJ, Goldbohm RA, van den Brandt PA. 2005. Dairy consumption and ovarian cancer risk in the Netherlands Cohort Study on Diet and Cancer. Br J Cancer 94:165–70.
Moorman PG, Terry PD. 2004. Consumption of dairy products and the risk of breast cancer: a review of the literature. Am J Clin Nutr 80:5–14.
Moss MO. 2002. Risk assessment for aflatoxins in foodstuffs. Intl Biodeterior Biodegrd 50:137–42.
Newmark HL, Wargovich MJ, Bruce WR. 1984. Colon cancer and dietary fat, phosphate, and calcium: a hypothesis. J Natl Cancer Inst 72:1323–5.
Norat T, Riboli E. 2003. Dairy products and colorectal cancer. A review of possible mechanisms and epidemiological evidence. Eur J Clin Nutr 57:1–17.
Norgauer C. 2005. Ecological study of the role of highly processed milk, meat and vegetable oil in prostate cancer causation. Boca Raton, Fla: Universal-Publishers.
Nwosu V, Carpten J, Trent JM, Sheridan R. 2001. Heterogeneity of genetic alterations in prostate cancer: evidence of the complex nature of the disease. Hum Mol Genet 10:2313–8.
O’Brien N, O’Callaghan Y, Lyons N, Woods J. 2000. Biological effects of dietary cholesterol oxidation products. Irish J Agric Food Res 265–73.
Ohashi Y, Nakai S, Tsukamoto T, Masumori N, Akaza H, Miyanaga N, Kitamura T, Kawabe K, Kotake T, Kuroda M. 2002. Habitual intake of lactic acid bacteria and risk reduction of bladder cancer. Urol Intl 68:273–80.
Outwater J, Nicholson A, Barnard N. 1997. Dairy products and breast cancer: the IGF-I, estrogen, and bGH hypothesis. Med Hypotheses 48:453–61.
Park Y, Leitzmann MF, Subar AF, Hollenbeck A, Schatzkin A. 2009. Dairy food, calcium, and risk of cancer in the NIH-AARP Diet and Health Study. Arch Intl Med 169:391–401.
Parkin DM, Bray F, Ferlay J, Pisani P. 2005. Global cancer statistics, 2002. CA-Cancer J Clin 55:74–108.
Parodi P. 1999. Conjugated linoleic acid and other anticarcinogenic agents of bovine milk fat. J Dairy Sci 82:1339–49.
Parodi P. 2007. A role for milk proteins and their peptides in cancer prevention. Curr Pharm Des 13:813–28.
Parodi P. 2008. Milk lipids: their role as potential anti-cancer agents. Sci des Aliments 28:44–52.
Parodi PW. 1997. Cows’ milk fat components as potential anticarcinogenic agents. J Nutr 127:1055–60.
Parodi PW. 1998. A role for milk proteins in cancer prevention. Aust J Dairy Technol 53:37–47.
Parodi PW. 2001. Cow’s milk components with anti-cancer potential. Aust J Dairy Technol 56:65–73.
Parodi PW. 2005. Dairy product consumption and the risk of breast cancer. J Am Coll Nutr 24:556S–68S.
Parodi PW. 2009. Dairy product consumption and the risk of prostate cancer. Intl Dairy J 19:551–65.
Parodi PW. 2012. Impact of cows’ milk estrogen on cancer risk. Intl Dairy J 22:3–14.
Pihlanto-Leppälä A, Rokka T, Korhonen H. 1998. Angiotensin I converting enzyme inhibitory peptides derived from bovine milk proteins. Intl Dairy J 8:325–31.
Pollak MN, Schernhammer ES, Hankinson SE. 2004. Insulin-like growth factors and neoplasia. Nat Rev Cancer 4:505–18.
Prandini A, Tansini G, Sigolo S, Filippi L, Laporta M, Piva G. 2009. On the occurrence of aflatoxin M1 in milk and dairy products. Food Chem Toxicol 47:984–91.
Prinz-Langenohl R, Fohr I, Pietrzik K. 2001. Beneficial role for folate in the prevention of colorectal and breast cancer. Eur J Nutr 40:98–105.
Prosser CG, Fleet IR, Corps AN. 1989. Increased secretion of insulin-like growth factor I into milk of cows treated with recombinantly derived bovine growth hormone. J Dairy Res 56:17–26.
Qin L, Xu J, Wang P, Tong J, Hoshi K. 2007. Milk consumption is a risk factor for prostate cancer in Western countries: evidence from cohort studies. Asia Pac J Clin Nutr 16:467–76.
Qin LQ, Wang PY, Kaneko T, Hoshi K, Sato A. 2004a. Estrogen: one of the risk factors in milk for prostate cancer. Med Hypotheses 62: 133–42.
Qin LQ, Xu JY, Wang PY, Ganmaa D, Li J, Wang J, Kaneko T, Hoshi K, Shirai T, Sato A. 2004b. Low-fat milk promotes the development of 7,12-dimethylbenzo anthracene (DMBA)-induced mammary tumors in rats. Intl J Cancer 110:491–6.
Radosavljević V, Jankovc S, Marinković J, Djokić M. 2003. Fluid intake and bladder cancer. A case control study. Neoplasma 50:234–8.
Ramasamy I. 2006. Recent advances in physiological calcium homeostasis. Clin Chem Lab Med 44:237–73.
Rayes AAH, El-Naggar SMM, Mehanna NS. 2008. The effect of natural fermented milk in the protection of liver from cancer. Nutr Food Sci 38:578–92.
RDAs NRCSotTEot, Allowances NRC CoD. 1989. Recommended dietary allowances. Washington DC: National Academies Press.
Reichardt JK, Woo SL. 1991. Molecular basis of galactosemia: mutations and polymorphisms in the gene encoding human galactose-1-phosphate uridylyltransferase. Proc Natl Acad Sci USA 88:2633–7.
Reichel H, Koeffler HP, Norman AW. 1989. The role of the vitamin D endocrine system in health and disease. N Engl J Med 320:980–91.
Renehan AG, Zwahlen M, Minder C, O’Dwyer ST, Shalet SM, Egger M. 2004. Insulin-like growth factor (IGF)-I, IGF binding protein-3, and cancer risk: systematic r view and meta-regression analysis. The Lancet 363:1346–53.
Rodland KD. 2004. The role of the calcium-sensing receptor in cancer. Cell Calcium 35:291–5.
Rodrigues L, Teixeira J, Schmitt F, Paulsson M, Månsson HL. 2008. Lactoferrin and cancer disease prevention. Crit Rev Food Sci 49:203–17.
Rodríguez-Alcalá LM, Fontecha J. 2007. Hot topic: fatty acid and conjugated linoleic acid (CLA) isomer composition of commercial CLAfortified dairy products: evalu tion after processing and storage. J Dairy Sci 90:2083–90.
Rökman A, Ikonen T, Seppälä EH, Nupponen N, Autio V, Mononen N, Bailey-Wilson J, Trent J, Carpten J, Matikainen MP. 2002. Germline alterations of the RNASEL gene, a candidate HPC1 gene at 1q25, in patients and families with prostate cancer. Am J Hum Genet 70: 1299–304.
Ross RK, Henderson BE. 1994. Do diet and androgens alter prostate cancer risk via a common etiologic pathway? J Natl Cancer Inst 86:252–5.
Saito H, Takase M, Tamura Y, Shimamura S, Tomita M. 1994. Physicochemical and antibacterial properties of lactoferrin and its hydrolysate produced by heat treatment at acidic pH. Adv Exp Med Biol 357:219–26.
Sandrine G, Boeriu CG, Wichers HJ. 2001. Caseins and casein hydrolysates. 2. Antioxidative properties and relevance to lipoxygenase inhibition. J Agric Food Chem 49:295–302.
Saunders D, Christensen C, Williams J, Wappler N, Lawrence W, Malone J, Malviya V, Deppe G. 1995. Inhibition of breast and ovarian carcinoma cell growth by 1, 25-dihydroxyvitamin D3 combined with retinoic acid or dexamethasone. Anticancer Drugs 6:562–9.
Saunders DE, Christensen C, Lawrence WD, Malviya VK, Malone JM, Williams JR, Deppe G. 1992. Receptors for 1, 25-dihydroxyvitamin D3 in gynecologic neoplasms. Gynecol Oncol 44:131–6.
Saxelin M, Korpela R, Mäyrä-Mäkinen A, Mattila-Sandholm T, Saarela M. 2003. Introduction: classifying functional dairy products. In: Mattila-Sandholm T, Saarela M, editors. Functional dairy products. Cambridge, U.K.: CRC Press-Woodhead Publishing. P 1–16.
SCF (Scientific Committee for Food). 1975. Reports from the Scientific Committee for Food (1stseries), opinion expressed in 1975. No. 17.
SCF (Scientific Committee for Food). 1984. Reports of the Scientific Committee for Food (14th series), opinion expressed in 1983. No. 47-61.
Schmitz-Drager BJ, Eichholzer M, Beiche B, Ebert T. 2001. Nutrition and prostate cancer. Urol Intl 67:1–11.
Schrezenmeir J, de Vrese M. 2001. Probiotics, prebiotics, and synbiotics—approaching a definition. Am J Clin Nutr 73: 361S–4S.
Schulman C, Ekane S, Zlotta A. 2001. Nutrition and prostate cancer: evidence or suspicion? Urology 58:318–34.
Schuurman AG, van den Brandt PA, Dorant E, Brants HAM, Goldbohm A R. 1999. Association of energy and fat intake with prostate carcinoma risk. Cancer 86:1019–27.
Scudamore KA. 1998. In: Watson DH, editor. Natural toxicants in food. Sheffield: Sheffield Academic Press Ltd.
Seppo L, Jauhiainen T, Poussa T, Korpela R. 2003. A fermented milk high in bioactive peptides has a blood pressure-lowering effect in hypertensive subjects. Am J Clin Nutr 77:326–30.
Sergeev IN. 2005. Calcium signaling in cancer and vitamin D. J Steroid Biochem Mol Biol 97:145–51.
Sevanian A, Peterson A. 1986. The cytotoxic and mutagenic properties of cholesterol oxidation products. Food Chem Toxicol 24:1103–10.
Sieber R. 2005. Oxidised cholesterol in milk and dairy products. Intl Dairy J 15:191–206.
Sieri S, Krogh V, Ferrari P, Berrino F, Pala V, Thiébaut ACM, Tjønneland A, Olsen A, Overvad K, Jakobsen MU. 2008. Dietary fat and breast cancer risk in the European prospective investigation into cancer and nutrition. Am J Clin Nutr 88:1304–12.
Singh G, Arora S, Sharma GS, Sindhu JS, Kansal VK, Sangwan RB. 2007. Heat stability and calcium bioavailability of calcium-fortified milk. LWT—Food Sci Technol 40:625–31.
Slattery ML, Benson J, Berry TD, Duncan D, Edwards SL, Caan BJ, Potter JD. 1997. Dietary sugar and colon cancer. Cancer Epidemiol Biomarkers Prev 6:677–85.
Spanhaak S, Havenaar R, Schaafsma G. 1998. The effect of consumption of milk fermented by Lactobacillus casei strain Shirota on the intestinal microflora and immune parameters in humans. Eur J Clin Nutr 52:899–907.
Sung V, Feldman D. 2000. 1, 25-Dihydroxyvitamin D3 decreases human prostate cancer cell adhesion and migration. Mol Cell Endocrinol 164:133–43.
Swartz WJ, Mattison DR. 1988. Galactose inhibition of ovulation in mice. Fertil Steril 49:522–6.
Terry P, Suzuki R, Hu FB, Wolk A. 2001. A prospective study of major dietary patterns and the risk of breast cancer. Cancer Epidemiol Biomarkers Prev 10:1281–5.
Thiébaut ACM, Kipnis V, Chang SC, Subar AF, Thompson FE, Rosenberg PS, Hollenbeck AR, Leitzmann M, Schatzkin A. 2007. Dietary fat and postmenopausal invasive breast cancer in the National Institutes of Health—AARP diet and health study cohort. J Natl Cancer Inst 99: 451–62.
Thirabunyanon M, Boonprasom P, Niamsup P. 2009. Probiotic potential of lactic acid bacteria isolated from fermented dairy milks on antiproliferation of colon cancer cells. Biotechnol Lett 31:571–6.
Thompson IM, Goodman PJ, Tangen CM, Lucia MS, Miller GJ, Ford LG, Lieber MM, Cespedes RD, Atkins JN, Lippman SM, Carlin SM, Ryan A, Szczepanek CM, Crowley JJ, Coltman Jr. CA. 2003. The influence of finasteride on the development of prostate cancer. N Engl J Med 349:215–24.
Tomita K, Akaza H, Nomoto K, Yokokura T, Matsushima H, Homma Y, Aso Y. 1994. Influence of Lactobacillus casei on rat bladder carcinogenesis. Jpn J Urol 85:655–63.
Toriola AT, Surcel HM, Calypse A, Grankvist K, Luostarinen T, Lukanova A, Pukkala E, Lehtinen M. 2010. Independent and joint effects of serum 25-hydroxyvitamin D and calcium on ovarian cancer risk: a prospective nested case-control study. Eur J Cancer 46:2799–805.
Tsuda H, Kozu T, Iinuma G, Ohashi Y, Saito Y, Saito D, Akasu T, Alexander DB, Futakuchi M, Fukamachi K, Xu J, Kakizoe T, Iigo M. 2010. Cancer prevention by bovine lactoferrin: from animal studies to human trial. Biometals 23:399–409.
Tsuda H, Sekine K, Ki F, Iigo M. 2002. Cancer prevention by bovine lactoferrin and underlying mechanisms—a review of experimental and clinical studies. Biochem Cell Biol 80:131–6.
Tsuda H, Sekine K, Ushida Y, Kuhara T, Takasuka N, Iigo M, Han BS, Moore MA. 2000. Milk and dairy products in cancer prevention: focus on bovine lactoferrin. Mutat Res 462:227–33.
Turner P, Mendy M, Whittle H, Fortuin M, Hall A, Wild C. 2000. Hepatitis B infection and aflatoxin biomarker levels in Gambian children. Trop Med Intl Health 5:837–41.
van Boekel M. 1998. Effect of heating on Maillard reactions in milk. Food Chem 62:403–14.
van Loon AJM, Botterweck AAM, Goldbohm RA, Brants HAM, van den Brandt PA. 1997. Nitrate intake and gastric cancer risk: results from the Netherlands cohort study. Cancer Lett 114:259–61.
Varga L, Szigeti J, Kovács R, Földes T, Buti S. 2002. Influence of a Spirulina platensis biomass on the microflora of fermented ABT milks during storage. J Dairy Sci 85:1031–8.
Vecchia C, Negri E. 1996. Nutrition and bladder cancer. Cancer Cause Control 7:95–100.
Veierød MB, Laake P, Thelle DS. 1997. Dietary fat intake and risk of prostate cancer: a prospective study of 25,708 Norwegian men. Intl J Cancer 73:634–8.
Vieth R. 2001. Vitamin D nutrition and its potential health benefits for bone, cancer and other conditions. J Nutr Environ Med 11:275–91.
Villena-Heinsen C, Meyberg R, Axt-Fliedner R, Reitnauer K, Reichrath J, Friedrich M. 2002. Immunohistochemical analysis of 1, 25-dihydroxyvitamin-D3 receptors, estrogen and progesterone receptors and Ki-67 in ovarian carcinoma. Anticancer Res 22:2261–7.
Vyas HK, Tong PS. 2004. Impact of source and level of calcium fortification on the heat stability of reconstituted skim milk powder. J Dairy Sci
87:1177–80.
Wakabayashi H, Yamauchi K, Takase M. 2006. Lactoferrin research, technology and applications. Intl Dairy J 16:1241–51.
Walzem R, Dillard C, German J. 2002. Whey components: millennia of evolution create functionalities for mammalian nutrition: what we know and what we may be overlooking. Crit Rev Food Sci Nutr 42:353–75.
Ward MH, Kilfoy BA, Weyer PJ, Anderson KE, Folsom AR, Cerhan JR. 2010. Nitrate intake and the risk of thyroid cancer and thyroid disease. Epidemiology 21:389–95.
Ward P, Paz E, Conneely O. 2005. Lactoferrin. Cell Mol Life Sci 62:2540–8.
Watanabe K, Reddy BS, Wong CQ, Weisburger JH. 1978. Effect of dietary undegraded carrageenan on colon carcinogenesis in F344 rats treated with azoxymethane or methylnitrosourea. Cancer Res 38:4427–30.
Welsch CW. 1992. Relationship between dietary fat and experimental mammary tumorigenesis: a review and critique. Cancer Res 52:2040s–8s.
Wollowski I, Rechkemmer G, Pool-Zobel BL. 2001. Protective role of probiotics and prebiotics in colon cancer. Am J Clin Nutr 73:451S–55S.
Wu AH, Pike MC, Stram DO. 1999. Meta-analysis: dietary fat intake, serum estrogen levels, and the risk of breast cancer. J Natl Cancer Inst 91:529–34.
Yager JD, Davidson NE. 2006. Estrogen carcinogenesis in breast cancer. N Engl J Med 354:270–82.
Yorifuji T, Tsuda T, Doi H, Grandjean P. 2011. Cancer excess after arsenic exposure from contaminated milk powder. Environ Health Prev Med 16:164–70.
Yorifuji T, Tsuda T, Grandjean P. 2010. Unusual cancer excess after neonatal arsenic exposure from contaminated milk powder. J Natl Cancer Inst 102:360–1.
Yu H, Rohan T. 2000. Role of the insulin-like growth factor family in cancer development and progression. J Natl Cancer Inst 92:1472–89.
Zhang D, Mahoney AW. 1989. Effect of iron fortification on quality of Cheddar cheese. J Dairy Sci 72:322–32.
Zhang D, Mahoney AW. 1991. Iron fortification of process Cheddar cheese. J Dairy Sci 74:353–8.






