Abstract
Introduzione
Biomarker del bilancio energetico e dello stress ossidativo
- Biomarker nel sangue per la diagnosi del bilancio energetico negativo
- Biomarker nel latte per la diagnosi di bilancio energetico negativo
- Acidi grassi
- Glucosio
- Enzimi glicolitici
- Biomarker di stress ossidativo nel sangue e nel latte
Conclusioni e prospettive future
Ringraziamenti
Bibliografia
Journal of Dairy Research
cambridge.org/dar
Maya Zachut1, Marcela Šperanda2, André M. de Almeida3, Gianfranco Gabai4, Ali Mobasheri5,6,7 e Lorenzo E. Hernández-Castellano8
1Department of Ruminant Science, Institute of Animal Sciences, ARO, Volcani Center, Rishon Lezion 7505101, Israele; 2J.J.Strossmayer University of Osijek, Faculty of Agrobiotechnical Sciences Osijek, Vladimira Preloga 1 P.P. 117, 31000 Osijek, Croazia; 3LEAF – Linking Landscape, Environment, Agriculture And Food, Instituto Superior de Agronomia, Universidade de Lisboa, Tapada da Ajuda, 1349-017 Lisbona, Portogallo; 4Department of Comparative Biomedicine and Food Science, University of Padova, via dell’Università, 16 – Agripolis 35020 Legnaro, PD, Italia; 5Department of Regenerative Medicine, State Research Institute Centre for Innovative Medicine, 08661 Vilnius, Lituania; 6Faculty of Medicine, University of Oulu, Aapistie 5 A, FIN-90230 Oulu, Finlandia; 7Centre for Sport, Exercise and Osteoarthritis Versus Arthritis, Queen’s Medical Centre, Nottingham, Regno Unito e 8Department of Animal Science, AU-Foulum, Aarhus University, 8830 Tjele, Danimarca
Per citare questo articolo: Zachut M, Šperanda M, de Almeida AM, Gabai G, Mobasheri A and Hernández-Castellano LE (2020). Biomarkers of fitness and welfare in dairy cattle: healthy productivity. Journal of Dairy Research 87, 4–13. doi.org/10.1017/S0022029920000084
Ricevuto: 1 Novembre 2019
Revisionato: 11 Gennaio 2020
Accettato: 17 Gennaio 2020
Autore corrispondente: Marcela Šperanda, Email: marcela.speranda@fazos.hr
Parole chiave: biomarker, animali da latte, salute, produttività, benessere
Abstract
L’intensificazione della produzione di latte ha avuto diversi risvolti indesiderati, tra cui la comparsa di problematiche relative ad uno sviluppo sostenibile e all’inquinamento ambientale. L’incremento della produzione di latte che è stato raggiunto negli ultimi 70 anni, ha causato la comparsa di numerosi disturbi fisiopatologici e di salute in animali da latte ad elevato rendimento come, ad esempio, malattie metaboliche poco comuni in passato. L’aumento dell’insorgenza delle malattie metaboliche nei bovini e in altri animali domestici è un aspetto chiave della domesticazione che, non solo influisce sulla salute e sulla produttività degli animali, ma può avere anche ripercussioni importanti e negative sulla salute dei consumatori umani, a causa dell’elevato utilizzo di farmaci ed antibiotici. In futuro questi elementi andranno ad influenzare aspetti economici ed etici. Pertanto scoprire e determinare biomarkers adeguati per la diagnosi precoce delle malattie metaboliche è di grande interesse. In questa review viene presentato un recente lavoro sulla scoperta di biomarker di fitness, stress e benessere nelle vacche da latte, che si concentra in particolare sui possibili biomarker del bilancio energetico e dello stress ossidativo presenti nel plasma e nel latte e sui biomarker delle patologie correlabili alla produttività e alla diminuzione della fertilità.
Introduzione
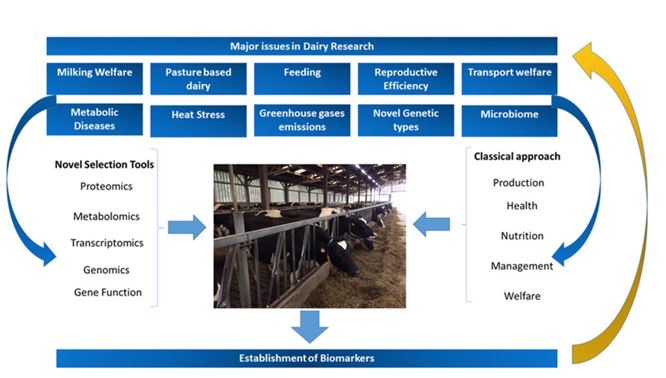
Questo è un articolo complementare alla nostra recente review sui biomarker relativi alla risposta allo stress dovuto a turbe ambientali negli animali da latte (Almeida et al., 2019) e si occupa dei biomarker correlati alla salute metabolica e alla produttività, comprendendo anche la fertilità. La maggior parte del latte e dei suoi derivati consumati oggi nelle zone del mondo più sviluppate provengono da sistemi di allevamento intensivi. All’interno di questi allevamenti è presente solitamente una sola razza: la bovina da latte Frisona Olandese. Le rese di questa razza sono aumentate costantemente negli ultimi 70 anni, fino a raggiungere rese medie di 20.000 kg di latte per lattazione di 305 giorni. Tali aumenti straordinari sono stati ottenuti principalmente grazie ai progressi nel campo della genetica, della nutrizione e dell’alimentazione, della gestione dell’attività riproduttiva, dell’inseminazione artificiale, della gestione della salute, del controllo ambientale e della progettazione e dell’efficienza della sala di mungitura: Roche et al. (2017), Douphrate et al. (2013) e Duncan et al. (2013). Invece, nei paesi tropicali, vengono allevate specie e razze da latte differenti, in particolare il bufalo d’acqua (Bubalus bubalis) e il Bos indicus. Inoltre, in queste zone i sistemi di produzione non sono così intensificati come quelli dei paesi con clima temperato. Va detto che anche i piccoli ruminanti (ovini e caprini) e i dromedari contribuiscono alla quantità di latte totale prodotto in tutto il mondo (Medhammar et al., 2012). Sebbene rappresenti una piccola parte della produzione mondiale di latte, anche questo settore è in costante crescita, soprattutto nei Paesi industrializzati (Pulina et al., 2018). Per maggiori informazioni, consultare il documento di localizzazione di Hernández-Castellano et al. (2019). Il settore lattiero-caseario si trova ad affrontare numerose sfide (Baumgard et al., 2017; Boor et al., 2017; Martin et al., 2017; McGuffey, 2017; Polsky e von Keyserlingk, 2017; Tan et al., 2017). Da un lato, risulta essere fondamentale continuare a migliorare e ad ottimizzare i livelli di produzione in particolare nei settori più classici della produzione animale (nutrizione, fisiologia dell’allattamento, biologia riproduttiva e gestione della salute), ma anche in quei settori che si occupano delle strutture presenti negli allevamenti da latte e della progettazione ed automazione delle sale mungitura. Dall’altro lato, il processo di intensificazione dell’allevamento ha portato diversi effetti indesiderati, spesso associati alla produzione lattiero-casearia, come la percezione di uno sviluppo sostenibile e l’inquinamento ambientale. Durante questa review non entreremo in questo dibattito, anche se ne riconosciamo l’importanza. Un’altra conseguenza dell’intensificazione è l’aumento della comparsa di diverse malattie metaboliche che non erano comuni in passato. Le malattie metaboliche del bestiame e degli altri animali domestici sono un aspetto chiave della domesticazione che non solo influisce sulla salute e sulla produttività degli animali, ma che ha anche conseguenze negative sui consumatori umani a causa dell’elevato impiego di farmaci e antibiotici (Raboisson et al., 2016). Tali malattie metaboliche includono, ad esempio, acidosi ruminale, mastite, chetosi e zoppia. Una diminuzione dell’insorgenza di queste patologie sarà un’importante area di ricerca nel prossimo futuro. Un altro aspetto che riguarda la produzione lattiero-casearia è quello relativo al benessere animale e a come questo sia compromesso dall’intensificazione dei sistemi di allevamento. Si tratta di un argomento sempre più importante per i consumatori, in particolare quando si parla di trasporto degli animali, diminuzione dello spazio individuale nelle stalle, separazione delle madri dai vitelli e dell’aumento dell’incidenza delle suddette malattie metaboliche. Anche questi saranno aspetti di crescente importanza economica ed etica per il settore lattiero-caseario nei prossimi anni. Pertanto, individuare e determinare adeguati biomarker del benessere sarà molto importante in futuro. Il termine “fitness animale” si riferisce alla capacità di ciascun soggetto, rispetto agli altri, di originare una prole vitale. Negli ultimi decenni, i programmi di allevamento delle vacche da latte si sono concentrati principalmente su caratteri e tratti correlati all’aumento della produzione di latte, con conseguenze negative per la fitness delle bovine (Essl, 1998). Altri aspetti relativi alla fitness delle bovine si possono ritrovare nel nostro documento di accompagnamento (Almeida et al., 2019). Le valutazioni quantitative di caratteri della fitness come la zoppia, la resistenza alla mastite, l’intervallo di parto e la durata della vita mostrano che, a causa del rapporto di antagonismo esistente tra la produttività e queste caratteristiche, potrebbe esistere un compromesso tra i costi legati ad una minor resa di latte e i benefici di un migliore stato di salute delle vacche (Koolhaas e van Rennen, 2016). Pertanto, per garantire una fitness ottimale alle moderne vacche da latte, è di grande interesse l’identificazione di biomarker specifici correlati ed essa. Sulla base di queste osservazioni, la sfida per i ricercatori del settore lattiero-caseario è quella di determinare dei biomarker consolidati, empirici e quantificabili per le malattie metaboliche, il benessere, la fitness e la salute delle vacche da latte, e questa sfida è al centro della presente review ( Figura 1).
Biomarker del bilancio energetico e dello stress ossidativo
A causa della repentina richiesta di energia per la produzione di latte, il passaggio dalla fase finale della gravidanza all’inizio della lattazione rappresenta un’importante sfida metabolica per le moderne vacche da latte. Durante questo periodo, l’assunzione energetica non è in grado di soddisfare il fabbisogno energetico necessario per il mantenimento delle funzioni corporee e per la produzione di latte, il che si traduce in un bilancio energetico negativo (NEB; Bell e Bauman, 1997; Drackley, 1999) e in un’elevata mobilizzazione del tessuto adiposo. Se l’animale non riesce ad adattarsi al NEB, il rischio di disturbi metabolici, tra i quali chetosi, ipocalcemia, mastite da steatosi epatica, aumenta notevolmente. Inoltre, nelle vacche da latte ad elevata produzione, il NEB è legato a tassi di concepimento più bassi, ad una mortalità embrionale precoce e ad estri silenti. I metodi tradizionali per individuare o prevenire il NEB si basano sulla ricerca di metaboliti nel sangue (come gli acidi grassi non esterificati, NEFA) e sul punteggio della condizione corporea (BCS; un punteggio soggettivo del grasso corporeo), che richiedono una complessa raccolta di dati (assunzione individuale di cibo e peso corporeo) o la raccolta invasiva e laboriosa di sangue, unitamente alla presenza di personale qualificato. Quindi, è evidente la necessità di individuare biomarker accurati, oggettivi e preferibilmente non invasivi che indichino lo stato energetico delle vacche da latte dopo il parto. In questa sezione verranno discussi i potenziali biomarker del NEB presenti nel sangue e nel latte delle bovine da latte. Questi sono di gran lunga i campioni più importanti per gli attuali approcci analitici, ma vale la pena sottolineare che anche altri tessuti e/o fluidi potrebbero rivelarsi utili in futuro, infatti un recente report ha esaminato la presenza di possibili biomarker metabolici in campioni di pelo (Möller et al., 2019).
Fig. 1. Principali problematiche ed aree di ricerca nei moderni sistemi di allevamento da latte e come affrontarle, evidenziando l’importanza dei tradizionali e dei nuovi strumenti di selezione nonché della messa a punto dei biomarker.
Biomarker nel sangue per la diagnosi del bilancio energetico negativo
Gli acidi grassi non esterificati (NEFA) e il β-idrossibutirrato (BHBA) sono probabilmente i parametri ematici più noti utilizzati per valutare il NEB nelle vacche da latte. Le concentrazioni di NEFA nel sangue riflettono l’entità della mobilizzazione dei grassi, mentre il BHBA indica l’ossidazione dei grassi nel fegato. Pertanto, questi due analiti vengono ampiamente utilizzati sul campo come indicatori del NEB (McArt et al., 2013; Ospina et al., 2013). È stato dimostrato che elevate concentrazioni di NEFA e BHBA nel sangue sono associate ad una diminuzione della produzione di latte (Duffield et al., 2009; Ospina et al., 2010; Chapinal et al., 2012), ad una diminuzione della funzionalità del sistema immunitario nel periodo del periparto e ad un aumento del rischio di malattie infettive (Moyes et al., 2009; Ospina et al., 2010). Concentrazioni di NEFA superiori a 0.3 e 0.6 mmol/l, rispettivamente prima e dopo il parto, sono associate ad un aumento del rischio di dislocazione dell’abomaso, chetosi clinica, ritenzione placentare e metriti (Ospina et al., 2010). Oltre ai NEFA, anche specifici acidi grassi (FA) presenti nel sangue potrebbero essere utilizzati come potenziali e alternativi biomarker per il NEB nelle vacche in transizione. Imhasly et al. (2015) hanno esaminato i cambiamenti del lipidoma del plasma sanguigno nelle vacche da latte in transizione, ed hanno visto che i livelli di un certo numero di trigliceridi (TG) erano più elevati nel pre-parto rispetto al post-parto: TG 48:3, TG 48:1, TG 48:1, TG 49:2, TG 49:1, TG 50:4, TG 50:3, TG 50:2, TG 51:3, TG 51:2, TG 51:1, TG 52:4, TG 52:3, TG 53:3, TG 54:6 e TG 56:6. Inoltre, i livelli di due ammidi degli acidi grassi (cioè linoleamide e anandamide) sono diminuiti solo al momento del parto (Imhasly et al., 2015), il che suggerisce la necessità di un maggiore fabbisogno energetico post-parto. Al contrario, i livelli di lisofosfatidilcolina (LPC) e fosfatidilcolina (PC), nello specifico: LPC 16:0, LPC 18:3, LPC 18:2, LPC 18:1, LPC 20:5, PC P-34:2, PC P-36:5, PC P-36:4 e PC 36:6, così come le sfingomieline 39:1 e 43:3, sono aumentati dopo il parto (Imhasly et al., 2015). Tuttavia, in questo studio non è stata analizzata la correlazione tra questi lipidi e i NEB individuali. Pertanto, non è chiaro se il NEB possa alterare il lipidoma del sangue nelle bovine. Nel plasma delle vacche che nel periodo del post-parto hanno un NEB, si evidenzia un incremento di biomarker dell’infiammazione, come il fattore di necrosi tumorale alfa, le proteine di fase acuta aptoglobina e siero amiloide A ed altre (Bradford et al., 2015). Questi biomarker dell’infiammazione possono essere utilizzati anche come indicatori del grado di NEB, poiché le vacche con un bilancio energetico negativo grave hanno un livello di infiammazione sistemica maggiore. Questo argomento viene esaminato in modo approfondito in Bradford et al. (2015).
Biomarker nel latte per la diagnosi di bilancio energetico negativo
Il potenziale dei biomarker presenti nel latte per la diagnosi NEB è enorme, poiché i sensori per l’individuazione di questi specifici marcatori potrebbero essere applicati nelle sale mungitura e sui robot di mungitura per fornire informazioni individuali sullo stato energetico delle vacche. Il BHBA, per esempio, può essere misurato nel latte e potenzialmente può essere misurato frequentemente nelle singole vacche durante la fase di lattazione precoce come indicatore di NEB (Duplessis et al., 2019).
Acidi grassi
I FA del latte possono essere utilizzata come biomarker di bilancio energetico (EB) nelle vacche da latte. Gli acidi grassi del latte originano da quattro vie principali (1) direttamente dalla dieta, (2) dalla sintesi ex-novo nella ghiandola mammaria, (3) dal rumine dove si formano per bioidrogenazione o degradazione batterica, e (4) dai depositi di grasso (Stoop et al., 2009). I cambiamenti dello status energetico durante la lattazione implicano anche dei cambiamenti nella composizione dei FA del latte (Gross et al., 2011). Nelle vacche con NEB, la sintesi ex-novo degli acidi grassi da parte della ghiandola mammaria (cioè da C6:0 a C14:0) si riduce in favore di una maggiore mobilitazione del grasso corporeo (van Knegsel et al., 2005). Infatti, con un EB gravemente negativo, le concentrazioni di FA a catena corta e media nel latte si riducono, mentre le concentrazioni di FA a catena lunga aumentano (Nogalski et al., 2012). Ciò può essere spiegato dal fatto che l’acido oleico (C18:1-cis9) è l’acido grasso predominante negli adipociti e viene rilasciato principalmente attraverso la lipolisi in caso di NEB (Rukkwamsuk et al., 2000). In realtà, Gross et al. (2011) hanno trovato una correlazione tra NEB e la percentuale di C18:1 cis9 nel latte (r2 = 0.77). Pertanto, la percentuale di questo acido grasso potrebbe essere utilizzata come biomarker per la diagnosi del bilancio energetico nelle bovine da latte.
Glucosio
Il glucosio è un altro possibile biomarker utile per la diagnosi di NEB. Il glucosio è un metabolita essenziale per le cellule epiteliali mammarie. Le cellule epiteliali mammarie non sintetizzano il glucosio perché deficitarie dell’enzima glucosio 6-fosfatasi (Scott et al., 1976). Pertanto, la concentrazione di glucosio nelle cellule epiteliali mammarie dipende dal glucosio trasferito dal sangue. Di conseguenza, le concentrazioni di glucosio nel latte riflettono la sua concentrazione nel citoplasma delle cellule epiteliali mammarie (Faulkner et al., 1981; Zhao, 2014). Il glucosio-6-fosfato (G6P) è un metabolita centrale della glicolisi, poiché è un composto intermedio della sintesi del lattosio e partecipa al primo step della glicolisi e della via del pentoso fosfato (PPP; Zhao, 2014). Su questa base, il G6P è stato proposto anche come biomarker per la diagnosi di NEB. Larsen e Moyes (2015) hanno analizzato 3200 campioni di latte di vacche Frisone e Jersey per la ricerca del glucosio libero e del G6P. Durante le prime 21 settimane di lattazione, le concentrazioni nel latte di glucosio libero sono progressivamente aumentate mentre le concentrazioni di G6P sono diminuite. Di conseguenza, Zachut et al. (2016) hanno riportato che le concentrazioni di glucosio nel latte erano correlate positivamente ai giorni di lattazione. Al contrario, la concentrazione media di G6P nel latte era più alta durante la prima settimana di lattazione ed appariva correlata negativamente ai giorni di lattazione (Zachut et al., 2016). Per questo, si è suggerito il rapporto G6P/glucosio del latte come biomarker dello stress ossidativo nelle cellule epiteliali mammarie (Zachut et al., 2016). Tale studio ha anche dimostrato che il rapporto G6P/glucosio è altamente correlato alle concentrazioni plasmatiche NEFA (r2 = 0.81, Zachut et al. 2016). Sono necessarie ulteriori ricerche per convalidare l’impiego del glucosio libero e del G6P come biomarker del bilancio energetico, per poterli potenzialmente utilizzare in futuro nei sistemi di sorveglianza in allevamento.
Enzimi glicolitici
Sulla base della correlazione tra il G6P del latte e l’EB, la glucosio-6-fosfato deidrogenasi (G6PDH), il primo enzima della via del pentoso fosfato, viene suggerito come biomarker del latte utile per la diagnosi di NEB nelle bovine. Solo pochi studi hanno riportato l’attività della G6PDH nel latte bovino. Analogamente a quanto riportato per le concentrazioni del G6P nel latte, Zachut et al. (2016) hanno mostrato che l’attività della G6PDH nel latte delle vacche era più alta nella prima e seconda settimana di lattazione, e che diminuiva fino alla quinta settimana di lattazione. Inoltre, l’attività della G6PDH è stata correlata con il G6P del latte (r2 = 0.68), con il rapporto G6P/glucosio (r2 = 0.53) e correlata negativamente ai giorni di lattazione (r2 = -0,69), all’ingestione di sostanza secca (r2 = -0.65) e al EB (r2 = -0.52; Zachut et al. 2016). È stato visto che l’attività della G6PDH del latte era 2 volte superiore nelle vacche con NEB alla terza settimana di lattazione rispetto a quelle con bilancio energetico positivo (dati non pubblicati). Sulla base di questi risultati, la G6PDH potrebbe tuttavia essere utilizzata come biomarker del latte per la diagnosi di NEB nelle vacche in fase iniziale di lattazione; comunque, sono necessarie ulteriori ricerche per convalidare questo biomarker.
Biomarker di stress ossidativo nel sangue e nel latte
Lo stress ossidativo può risentire del NEB, come conseguenza degli effetti pro-infiammatori legati alla mobilizzazione dei grassi (Sordillo et al., 2009; Bradford et al., 2015). Le richieste metaboliche associate alle fasi finali della gravidanza, al parto e all’inizio della lattazione possono far aumentare la produzione di specie reattive dell’ossigeno (ROS) (Esposito et al., 2014). La maggior parte degli ossidanti sono rappresentati dai ROS, ma anche le specie reattive dell’azoto (RNS) contribuiscono al pool di ossidanti, ed entrambi vengono prodotti durante gli stati fisiologici e patologici dell’organismo. Tutte le macromolecole come lipidi, proteine e DNA sono bersagli dello stress ossidativo (Mavangira et Sordillo, 2018). Esistono molti biomarker utili per la determinazione dello stress ossidativo legati al metabolismo dei lipidi e delle proteine; il più noto biomarker dell’ossidazione delle proteine è la misurazione dei gruppi carbonilici. Quando i ROS attaccano le catene amminoacidiche laterali di prolina, arginina, lisina e treonina, si generano i gruppi carbonilici. Un parametro più specifico per l’individuazione dell’ossidazione delle proteine è il 2,4-dinitrofenilidrazone (DNPH) che permette la determinazione dei gruppi carbonilici proteici totali (Mavangira et Sordillo, 2018). Durante il processo infiammatorio vengono generati prodotti dell’acido ipocloroso (Shacter, 2000). Il livello di ditirosina riflette il danno ossidativo delle proteine e la misurazione è possibile grazie alla chemiluminescenza (Bordignon et al., 2014). Durante la fase di transizione, le vacche sono esposte a numerosi processi ossidativi che possono compromettere il livello di antiossidanti: parto, NEB, rischio di chetosi, fecondazione, sviluppo embrionale precoce, gravidanza e concomitante lattazione, processi infiammatori della mammella (mastite subclinica) e dell’utero (endometrite subclinica), salute dell’apparato digerente, ecc. Si è visto che il rapporto tra il livello plasmatico dei prodotti derivati dall’ossidazione proteica e l’albumina (AOPP/albumina) è un indicatore sensibile dello stress ossidativo (Celi et al., 2011). A causa della mancanza di antiossidanti nell’insilato di mais, l’alimentazione delle vacche con questo prodotto genera un aumento della concentrazione di AOPP (Celi e Raadsma, 2010). Le cellule immunitarie sono particolarmente sensibili allo stress ossidativo, visto l’elevato contenuto di acidi grassi polinsaturi nella membrana cellulare che sono sensibili alla perossidazione con conseguente produzione di ROS (Spears e Weiss, 2008; Esposito et al., 2014, Celi e Gabai, 2015). Recentemente, Alharthi et al. (2018) hanno riportato un graduale aumento dei metaboliti reattivi dell’ossigeno (ROM) in un periodo di tempo che va dai -10 ai 20 giorni rispetto al momento del parto. Un report precedente aveva mostrato come le vacche con BCS inferiore, indicativo di NEB, avessero una diminuzione dell’attività della superossido dismutasi (SOD) e un quantitativo più elevato di ROM nel flusso sanguigno (Bernabucci et al., 2005). Inoltre, è stata osservata una correlazione significativa tra il quantitativo di AOPP del latte e la conta delle cellule somatiche (Guzzo et al., 2015). Pertanto, sembrerebbe che l’attività dei ROM e della SOD nel sangue possa essere utilizzata come biomarker dello stress ossidativo nelle vacche da latte. Un biomarker della perossidazione lipidica molto utilizzato la malondialdeide (MDA), un prodotto a basso peso molecolare che si genera durante la scomposizione degli acidi grassi polinsaturi (PUFA), può riflettere lo stress ossidativo dell’animale. Nel latte delle vacche PP, la concentrazione di MDA era più elevata durante la fase iniziale della lattazione e diminuiva in modo esponenziale, ed è stata inversamente correlata con i giorni in lattazione (Zachut et al., 2016). La capacità antiossidante del latte (valori ORAC) tendeva ad essere correlata negativamente ed in modo esponenziale con i giorni di lattazione (r2 = -0.29) e con il bilancio energetico (r2 = -0.30) e ad essere correlata positivamente e linearmente con il G6P presente nel latte (r2 = 0,25) (Zachut et al., 2016). Questo suggerisce che la MDA e l’ORAC possono essere impiegati come biomarker del latte dello stress ossidativo. Tuttavia, la MDA si è dimostrata un marcatore non conforme e variabile (Celi, 2010). Un biomarker più affidabile dell’ossidazione lipidica potrebbe essere un isoprostano misurato con ELISA, in quanto sono stati osservati livelli aumentati di 15-F2-IsoP durante la mastite da coliformi (Mavangira et al., 2016) e in presenza di infiammazione (Mavangira e Sordillo, 2018). Un recente studio ha dimostrato l’esistenza di una correlazione positiva tra le specie reattive dell’ossigeno e dell’azoto (RONS), l’indice di stato ossidativo (OSi, definito come il rapporto tra le specie reattive di ossigeno e azoto) e il potenziale antiossidante totale (r2 = 0.75), così come l’esistenza di una correlazione negativa tra OSi e il potenziale antiossidante del siero (AOP; r2 = -0.58). Un aumento nel rapporto indica un maggiore rischio di stress ossidativo dovuto ad un incremento della produzione di pro-ossidanti o all’esaurimento degli antiossidanti difensivi (Ling et al., 2018). Nelle bovine da latte, lo stress da calore ambientale può favorire lo stress ossidativo. Bernabucci et al. (2002) hanno riferito che le vacche in transizione sottoposte a stress da calore durante l’estate hanno una maggiore attività eritrocitaria, un incremento dell’attività della glutatione perossidasi, più tioli intracellulari e più MDA rispetto alle vacche in primavera, indicando una condizione di maggior stress ossidativo in estate nelle vacche da latte in transizione. Le concentrazioni plasmatiche del biomarker di stress ossidativo MDA erano più elevate nelle vacche da latte in transizione che partorivano durante l’estate ( in presenza di stress da calore) rispetto a quelle che partorivano in inverno (Zachut et al., 2017). In studi condotti su vacche sottoposte a stress da calore a metà lattazione, è stata riscontrata una riduzione dell’attività antiossidante plasmatica (Harmon et al., 1997). Ulteriori ricerche sono necessarie per stabilire l’utilità dello stress ossidativo come presunto biomarker dello stress da calore nei bovini.
Risultati ed applicazioni
Biomarker di patologie correlate alla produttività
Le bovine da latte sono uno degli animali più allevati in maniera intensiva al mondo. Le vacche ad elevato rendimento sono state selezionate geneticamente per un’elevata produzione di latte, il che aumenta la suscettibilità di questi animali a sviluppare alcune patologie come la mastite, l’ipocalcemia, l’acidosi ruminale, la chetosi e la zoppia. La definizione di biomarker per la diagnosi precoce di queste malattie è uno degli aspetti più importanti dell’attuale ricerca che si occupa del settore lattiero-caseario. La mastite, termine con cui si identifica un’infiammazione della mammella, è la malattia legata alla produzione più diffusa nelle mandrie di bovine da latte in tutto il mondo. Nei ruminanti da latte, la mastite è spesso causata da infezioni intramammarie. Queste infezioni spesso hanno un impatto sul benessere degli animali e contribuiscono alle perdite economiche per gli allevatori (Halasa et al., 2007; Hernández-Castellano et al., 2011). Attualmente, la tecnica più sensibile a nostra disposizione per il rilevamento di mastiti cliniche e subcliniche è la SCC o conta delle cellule somatiche (Schukken et al., 2003), mentre l’identificazione degli agenti patogeni richiede l’esecuzione di una coltura batterica (Nyman et al., 2014) o metodi molecolari come la PCR. I test diagnostici da campo o i test di laboratorio (Point of Care test) per l’identificazione batterica sono sempre più disponibili, ma non sono ancora in uso su larga scala (Jones et al., 2019). Oltre alla risposta immunitaria innata, rappresentata dall’aumento della SCC, anche le immunoglobuline (principalmente le IgG) sono componenti importanti della risposta immunitaria specifica, che passa dal sangue al latte durante la mastite (Wall et al., 2016a, 2016b). L’aumento delle IgG nel latte sembrerebbe dipendere dall’agente patogeno coinvolto, quindi il suo utilizzo in associazione con la SCC sembrerebbe utile nella previsione dell’agente patogeno causa di mastite (Hernández-Castellano et al., 2017a, 2017a). Le misurazioni in linea delle IgG sono attualmente in fase di sviluppo per l’impiego a livello di allevamento (Lemberskiy-Kuzin et al., 2019), ma la tecnologia non è ancora disponibile per gli allevatori. Pertanto, per il rilevamento e la diagnosi precoce di mastite sono stati proposti biomarker alternativi, come la lattato deidrogenasi (LDH) e la conta differenziale delle cellule somatiche (DSCC) (Chagunda et al., 2006; Damm et al., 2017; Wall et al., 2018). L’impiego di tecnologie omiche nel campo delle mastiti nelle vacche da latte, ha fornito conoscenze sulle diverse componenti coinvolte nel corso della malattia e su come tali componenti possano essere influenzate dall’agente patogeno causa di mastite. Ad esempio, Thomas et al. (2016a, 2016b) e Mudaliar et al. (2016) hanno utilizzato la peptidomica, la metabolomica e la proteomica quantitativa per analizzare il latte proveniente da animali affetti da mastiti causate da Streptococcus uberis. Questi autori hanno individuato diversi componenti come i peptidi derivati dalla caseina, i peptidi delle molecole di adesione cellulare dipendenti dalla glicosilazione, la siero amiloide A, i peptidi antimicrobici e diversi metaboliti correlati all’infiammazione. Tuttavia, Kusebauch et al. (2018) hanno affermato che i batteri gram-negativi causavano cambiamenti più rapidi e più intensi nel proteoma del latte rispetto ai batteri gram-positivi. Basandosi su questa differenza di espressione nel latte, gli autori hanno proposto potenziali biomarker per distinguere tra mastite causata da batteri gram-negativi e da gram-positivi. Questi biomarker erano rappresentati da α-2 macroglobulina, α-1 antitripsina, aptoglobina, siero-amiloide A3, cluster di differenziazione CD14, calgranulina B, calgranulina C, catepsina C, vanina-1, galectina-1, galectina-3 ed interleuchina 8. Questo campo è in continua crescita ed è probabile che in futuro venga esteso anche ad altre specie in studio, come i piccoli ruminanti (Katsafadou et al., 2015; Hernández-Castellano et al., 2016a, 2016b; Vasileiou et al., 2019) e il bufalo d’acqua (Patbandha et al., 2015). Numerosi biomarker possono essere applicabili a più specie diverse da quella bovina; ad esempio, è stato proposto l’impiego della catelicidina nelle capre (Tedde et al., 2019). Questo ambito è stato recentemente sottoposto a review da Almeida e Eckersall (2018) e da Boschetti et al. (2019). Le malattie metaboliche sono di solito legate ad un aumento della domanda di uno specifico nutriente che diventa carente in determinate condizioni. Nel caso delle bovine da latte, particolare attenzione deve essere posta all’inizio della lattazione, quando l’improvvisa elevata richiesta di nutrienti per la produzione di latte fa aumentare il carico metabolico dell’animale (Weaver et al., 2017). Le malattie metaboliche più comuni nelle vacche da latte sono l’ipocalcemia (HC), la chetosi (KT) e l’acidosi ruminale (RA). L’ipocalcemia si verifica principalmente all’inizio della lattazione quando la rapida ed elevata richiesta di calcio da parte della ghiandola mammaria per la produzione di latte fa diminuire le concentrazioni di calcio circolante al di sotto di 1.4 mmol/l (HC clinica) o al di sotto di 2 mmol/l (HC subclinica) (Hernández-Castellano et al., 2017b). Analogamente alla HC, nelle bovine la KT si verifica quando la richiesta di energia supera la sua assunzione, con conseguente bilancio energetico negativo (Zarrin et al., 2013). Per evitare la KT, è necessario fornire energia sufficiente attraverso l’alimentazione. Tuttavia, quando questi elevati fabbisogni alimentari (per la produzione di latte) vengono soddisfatti con diete contenenti elevate quantità di carboidrati rapidamente fermentescibili (cioè amido) e a basso contenuto di fibre, le popolazioni batteriche ruminali vengono alterate. Di conseguenza, gli acidi (come il lattato) e il glucosio si accumulano, facendo diminuire il pH ruminale (pH < 4.8) e portando ad acidosi ruminale (RA, l’animale non è in grado di ripristinare i livelli di pH da solo) o ad acidosi ruminale subacuta (SARA, l’animale è in grado di ripristinare i normali livelli di pH in poche ore). Questa malattia metabolica danneggia la parete ruminale e intestinale e diminuisce il pH del sangue, portando all’acidosi metabolica. Il rapido sviluppo di nuove tecnologie dei sensori ha permesso la creazione di strumenti in grado di fornirci informazioni individuali e dinamiche sugli animali (Caja et al., 2016). Inoltre, le innovazioni della robotica ci hanno fornito l’opportunità di sviluppare sistemi performanti per l’alimentazione personalizzata delle vacche da latte sulla base delle loro specifiche ed individuali esigenze nutrizionali e fisiologiche. Il flusso costante di informazioni può essere utilizzato per monitorare le vacche e quindi prevenire queste malattie metaboliche nelle stalle da latte, come evidenziato di seguito. È abbastanza evidente che il calcio nel sangue è il miglior indicatore per la diagnosi di HC. Tuttavia, numerosi nuovi biomarker possono essere utilizzati per determinare lo status del calcio nell’animale e prevenire l’HC. Il pH delle urine potrebbe essere utilizzato come indicatore dell’equilibrio acido-base nel sangue (Thilsing-Hansen et al., 2002). In vicinanza del parto, è conveniente instaurare nelle vacche uno stato fisiologico di acidosi sistemica compensata, fornendo loro diete con una differenza negativa di cationi e anioni. Questa acidosi verrà in parte compensata dal riassorbimento del calcio osseo (Lemann et al., 2003). Pertanto, le vacche con pH urinario compreso tra 5.5 e 6.2 in vicinanza del parto vengono considerate in acidosi temporanea, che è associata ad una diminuzione dell’HC (Horst et al., 1997). Nel caso della KT, il biomarker più comunemente utilizzato per la sua diagnosi è la concentrazione di BHB nel sangue >1.4 mmol/l. Tuttavia, anche altri elementi come i NEFA, il glucosio, il glucagone o l’insulina risentono della KT. Geishauser et al. (1998) e Koeck et al. (2014) hanno mostrato come il BHB misurato nel latte sia correlato al BHB misurato nel sangue. Sulla base di questo principio, i moderni robot di mungitura includono le misurazioni del BHB presente nel latte, fornendo informazioni costanti sullo stato energetico dell’animale e contribuendo alla prevenzione della KT. Uno dei biomarker più ovvi dell’acidosi ruminale è il valore di pH del fluido ruminale. Le sonde wireless per la misurazione del pH contenute nei boli ruminali ci trasmettono il valore del pH ruminale in tempo reale, ma la registrazione del pH può differire a seconda del compartimento in cui la sonda è posizionata (Neubauer et al., 2018). Oltre al pH ruminale, altri biomarker per la rilevazione di RA o SARA possono essere misurati nel sangue, nelle urine, nelle feci o nel latte. Nel sangue, il D-lattato è stato proposto come biomarker per la SARA (Larsen, 2017) in quanto viene sintetizzato esclusivamente nel rumine dai lattobacilli e dai bifidobatteri (Ewaschuk et al., 2005) ed è scarsamente metabolizzato dai mammiferi. Di conseguenza, il D-lattato si accumula nei fluidi corporei come il latte e potrebbe essere usato come biomarcatore per la diagnosi di RA (Ewaschuk et al., 2005). Oltre al D-lattato, Danscher et al. (2015) hanno descritto anche che la RA (o la SARA) non influenzano il contenuto di proteine del latte ma riducono il contenuto di grassi del latte, rispetto a quanto evidenziato nelle bovine di controllo (4.14 e 5.08%, rispettivamente). Pertanto, gli animali con un rapporto grasso/proteina del latte inferiore a 1 sono più soggetti a sviluppare RA o SARA (Danscher et al., 2015); Vlček et al., 2016; Rojo-Gimeno et al., 2018).
Biomarker dello status riproduttivo
Una gestione efficiente della fertilità richiede una stretta collaborazione tra allevatori e veterinari, un’analisi accurata dei dati raccolti in allevamento ed accurati dati clinici. Infatti la ridotta fertilità può essere considerata un indicatore di cattiva salute e scarso benessere (Walsh et al., 2011, Gabai et al. 2018). Pertanto, lo sviluppo e la continua verifica di biomarker specifici per la fertilità è molto importante nel settore della ricerca del comparto lattiero-caseario. Per decidere un’adeguata strategia di gestione della riproduzione è necessario monitorare diversi fattori. Per quanto riguarda l’efficienza riproduttiva è ampiamente riconosciuta da tutti l’importanza della rilevazione dell’estro, ma occorre anche tenere in considerazione la ripresa dell’attività ovarica e la salute uterina durante il puerperio. La diagnosi di gravidanza deve essere eseguita il più precocemente possibile dopo l’inseminazione artificiale (IA) e l’eventuale fallimento del concepimento deve essere discriminato dalla perdita embrionale. Il progesterone ci indica la presenza di un corpo luteo attivo. Pertanto, è stato utilizzato per decenni come biomarker dell’efficienza riproduttiva (Veronesi et al., 2002). Dato che il progesterone può passare dal sangue al latte, quello presente nel latte viene considerato un biomarker non invasivo (idoneo negli animali da latte) dello status riproduttivo (Xu et al., 2005, 2013; Kappel et al., 2007; Posthuma-Trumpie et al., 2009; Oku et al., 2011), anche se la misurazione del progesterone di solito risulta essere troppo costosa per poterla applicare diffusamente per periodi di diverse settimane e in un gran numero di animali. Inoltre, il campionamento manuale non è pratico negli allevamenti commerciali, dove è necessario monitorare grandi mandrie tramite l’impiego di sistemi di campionamento automatizzati. Come descritto in precedenza, la rilevazione dell’estro è essenziale per mantenere un’elevata efficienza riproduttiva nelle mandrie di bovine da latte. Negli ultimi anni sono stati compiuti notevoli progressi per quanto riguarda il rilevamento automatizzato dell’estro negli allevamenti. La maggior parte dei sistemi di rilevamento si basano sulla registrazione dell’attività motoria delle vacche e monitorano i segni comportamentali dell’estro, utilizzando rilevatori in grado di individuare il fermo alla monta e/o misuratori dell’attività (Saint-Dizier e Chastant-Maillard, 2012). Questi sistemi mostrano elevati gradi di sensibilità e specificità se testati in contesti sperimentali, ma la loro efficienza può essere influenzata dalle condizioni ambientali (ad esempio: condizioni di stabulazione e pavimentazione) e dalla salute degli animali (ad esempio presenza di zoppia) (Saint-Dizier e Chastant-Maillard, 2012). L’impiego del progesterone presente nel latte in combinazione con tali sistemi di rilevamento basati sull’attività motoria delle bovine, ha portato ad un miglioramento dell’efficienza nella rilevazione dell’estro. Un sistema completamente automatizzato per la misurazione del progesterone nel latte (Herd Navigator®, Lattec, DK) è disponibile in Europa e in Canada e può essere abbinato con il robot di mungitura o la sala di mungitura di DeLaval® (Mazeris, 2010) e permette l’analisi e l’interpretazione di campioni prelevati con una certa frequenza (Friggens e Chagunda, 2005; Friggens et al., 2008). L’analisi del progesterone plasmatico e di quello presente nel latte, unitamente ai risultati clinici, viene utilizzata per effettuare una diagnosi di cicli estrali atipici e per identificare quelle bovine potenzialmente ipofertili (Lamming e Darwash, 1998). Un ritardo nella ripresa dell’attività ovarica post-parto e prolungate fasi luteali causano, comunemente, una diminuzione della fertilità (Lamming e Darwash, 1998; Gautam et al., 2010; Ranasinghe et al., 2011) e una ridotta sopravvivenza embrionale (Santos et al., 2009). Una corretta regolazione endocrina durante la fase follicolare è molto importante per una buona fecondazione (Starbuck et al., 2006). Un accurato monitoraggio sia del calo pre-ovulatorio del progesterone nel latte che del suo aumento post-inseminazione, può aiutarci ad identificare gli animali con fertilità compromessa, in quanto la secrezione di progesterone è direttamente responsabile dello sviluppo embrionale fin dalle primissime fasi della gravidanza (Green et al., 2005; Stronge et al., 2005; McNeill et al., 2006). Ad esempio, basse concentrazioni di progesterone nel latte intorno ai 4-7 giorni dopo l’inseminazione sono associate ad una bassa fertilità e ad un aumento del rischio di perdita embrionale (McNeill et al., 2006). Le concentrazioni di progesterone possono essere alterate anche dal metabolismo epatico (Rhinehart et al., 2009). Nelle vacche da latte, il citocromo CYP2C (che converte il progesterone in 21-idrossiprogesterone) e l’aldo-cheto reduttasi AKR1C (che converte il progesterone in 20α-idrossiprogesterone) sono gli enzimi più attivi nel fegato (Lemley e Wilson, 2010). Studi futuri dovrebbero concentrarsi nel testare i metaboliti del progesterone come potenziali biomarker della fertilità. Vale la pena notare come l’assunzione di cibo giochi un ruolo importante nella regolazione del metabolismo del progesterone, alterando il flusso sanguigno del fegato e gli enzimi epatici (Sangsritavong et al., 2002; Lemley et al., 2011; Hart et al., 2014). I profili del progesterone possono essere modellati matematicamente (Friggens e Chagunda, 2005; Blavy et al., 2016) per definire profili “tipici” e “atipici”. L’analisi a posteriori delle registrazioni in linea di dati sul progesterone, unitamente ad accurate informazioni cliniche, offre la possibilità unica di sviluppare modelli biologici utili per la gestione delle bovine. Alcune delle potenziali applicazioni riguardano l’identificazione di cicli estrali anomali responsabili della scarsa fertilità (Bruinjé et al., 2017a) o la realizzazione di profili di progesterone del latte che possono essere utili per prevedere l’esito dell’IA (Bruinjé et al., 2017b). In futuro, le informazioni ottenute dai dispositivi che rilevano l’attività motoria e i profili di progesterone potranno essere combinate con nuovi indicatori misurabili nel latte, cosicché potranno mostrare leggere ma significative variazioni del ciclo riproduttivo (Toledo-Alvarado et al., 2018). Come descritto sopra, le concentrazioni di progesterone non possono essere considerate come un biomarker sensibile per la diagnosi di gravidanza o per il rilevamento di perdite embrionali, soprattutto quando la morte embrionale avviene prima della regressione del CL (Szenci et al., 2000). La misurazione di specifici metaboliti della gravidanza è uno strumento sinergico per la diagnosi di gravidanza e di morte embrionale. Le glicoproteine associate alla gravidanza (PAGs) sono una grande famiglia di glicoproteine specificamente prodotte dal trofoblasto della placenta delle specie ungulate. Le glicoproteine associate alla gravidanza si trovano nel sangue materno a partire dalla terza settimana circa di gravidanza (Wallace et al., 2015). Le concentrazioni plasmatiche di PAG-1 nelle vacche sembrerebbero essere un buon biomarker per la diagnosi di gravidanza e di perdita embrionale a partire dal ventottesimo giorno dopo l’IA, se l’intervallo di tempo tra il parto e l’inseminazione è di almeno 60 giorni (Haugejorden et al., 2006; Friederick e Holtz, 2010; Celi et al., 2011; Barbato et al., 2013). Le concentrazioni di PAG nel latte sono 20-30 volte inferiori rispetto a quelle nel plasma (Friederick e Holtz, 2010). Pertanto, la maggior parte dei saggi disponibili non sono idonei per la misurazione delle PAG nel latte prima del sessantesimo giorno di gravidanza (Friederick e Holtz, 2010; LeBlanc, 2013; Lawson et al., 2014). Tuttavia, Melo Sousa et al. (2015) hanno sviluppato un saggio con dosaggio immunoradiometrico in grado di misurare le PAG nel latte ( a livello di picogrammi), che potrebbe essere utilizzato per la diagnosi di gravidanza in allevamenti con bassa fertilità. La diminuzione della salute uterina durante i primi 45 giorni post-parto riduce la fertilità nelle vacche da latte. Inoltre, in questi animali aumenta il rischio di sviluppare endometrite clinica o subclinica (Kasimanickam et al., 2004; Sheldon et al., 2009; Walsh et al., 2011). La percentuale di endometrite nelle vacche da latte è molto variabile (5-68%). Tra i fattori che possono influire su questa variabilità di percentuale ricordiamo le tempistiche con cui viene svolto l’esame dopo il parto e le metodiche diagnostiche (de Boer et al., 2014). Per ridurre tale variabilità, sarebbe utile la messa a punto di un test in vivo per il rilevamento dell’infiammazione uterina nella vacca (ad esempio, tramite specifici nasi elettronici). I nasi elettronici sono costituiti da una serie di sensori elettronici per la rilevazione chimica di molecole volatili. Tra le altre cose, questi strumenti sono portatili, più economici, più veloci e più facili da manipolare rispetto alla tecnica gas-cromatografica. Tuttavia, la loro bassa specificità è uno dei fattori più limitanti il loro impiego (Kou et al., 2017). Sebbene imperfetti, i nasi elettronici sono uno strumento sensato per il miglioramento della valutazione degli odori provenienti dalle secrezioni vaginali (Sannmann et al., 2013). Il naso elettronico mostra una maggiore ripetibilità intra-saggio se messo a confronto con il naso umano, sebbene non sia in grado di discriminare completamente tra gli agenti patogeni causa di endometrite (Burfeind et al., 2014).
Conclusioni e prospettive future
Questo articolo riassume le attuali conoscenze su alcuni biomarker relativi ad importanti aspetti che riguardano la produttività e il benessere degli animali nelle stalle da latte e pone l’accento sulla ricerca futura che deve essere condotta per migliorarne le prestazioni e il benessere. In futuro, l’emergere di nuove tecnologie (approcci omici e biologia dei sistemi) contribuirà probabilmente ad identificare dei biomarker attribuibili a specifici problemi di salute e benessere a partire fin dalle fasi iniziali della loro insorgenza. Inoltre sono necessarie procedure analitiche più rapide e più sensibili. Ad esempio, per il rilevamento delle mastiti si può ottenere un’enorme semplificazione della complessità del proteoma del latte, sfruttando la selettività derivante dalla particolare topografia delle nanoparticelle di maghemite attive in superficie, che può permetterci la rapida determinazione (tramite una strategia diagnostica all’avanguardia) di putativi biomarker nascosti (Magro et al., 2018). Alcuni biomarker, sebbene riconosciuti come molto specifici, devono essere ancora integrati in sistemi, piattaforme e tecnologie automatizzate in modo da poter essere utilizzati da allevatori e veterinari. Ad esempio, sebbene le PAG possano essere considerate degli specifici biomarker per la diagnosi di gravidanza e per la salute del feto, non vengono ancora pienamente adottate a livello di allevamento. I biomarker possono essere modellati matematicamente per creare modelli biologici utili nelle decisioni gestionali. Pertanto, nel prossimo futuro la tecnologia dell’intelligenza artificiale potrebbe trarre vantaggio dall’esaminare le banche dati disponibili. Ad esempio, le concentrazioni di progesterone e di BHB possono essere misurate nel latte e, quindi, possono essere utilizzate per creare dei grandi data set. La messa a punto di strategie efficaci utili a migliorare le performance, la salute e il benessere degli animali da latte richiederà la collaborazione di una vasta gamma di specializzazioni e dovranno essere coinvolti allevatori, veterinari, consulenti e bio-informatici. Molte metodiche le ritroviamo sotto il termine “zootecnia di precisione”, che viene definita come un insieme di tecnologie di monitoraggio in tempo reale finalizzate alla gestione partendo dalla più piccola unità di produzione. Ciò implica un nuovo approccio, basato sull’impiego di macchinari utili ad individuare le patologie più significative presenti nell’allevamento intensivo dei bovini da latte (zoppia, mastite, chetosi; Halachmi e Guarino, 2016), così come a quantificare il dolore e lo stress, il NEB, la frequenza cardiaca, la presenza di un certo odore, ecc. (Halachmi et al. 2019). Il monitoraggio degli animali informerà gli allevatori della presenza di alterazioni già nelle prime fasi di determinate patologie, favorendo un miglioramento delle performance, della salute e del benessere degli animali.
Ringraziamenti
Questo articolo si basa sul lavoro di COST Action FA1308 DairyCare (DairyCare, 2016), sostenuto da COST (European Cooperation in Science and Technology). COST è un’organizzazione intergovernativa paneuropea. La sua missione è quella di consentire lo sviluppo di innovazioni scientifiche e tecnologiche che portino a nuovi concetti e prodotti, contribuendo così a rafforzare le capacità di ricerca e di innovazione dell’Europa.
Bibliografia
Alharthi A, Zhou Z, Lopreiato V, Trevisi E and Loor JJ (2018) Body condition score prior to parturition is associated with plasma and adipose tissue biomarkers of lipid metabolism and inflammation in Holstein cows. Journal of Animal Science and Biotechnology 9, 12.
Almeida AM and Eckersall PD (2018) Proteomics and mammary gland research in dairy Species. In de Almeida AM, Eckersall D and Miller I (eds), Proteomics in Domestic Animals: From Farm to Systems Biology. Cham, Switzerland: Springer International Publishing, pp. 255–280.
Almeida AM, Zachut M, Hernández-Castellano LE, Šperanda M, Gabai G and Mobasheri A (2019) Biomarkers of fitness and welfare in dairy animals: healthy living. Journal of Dairy Research 86, 379–387.
Barbato O, Merlo M, Celi P, Sousa NM, Guarneri L, Beckers JF and Gabai G (2013) Relationship between plasma progesterone and pregnancy-associated glycoprotein concentrations during early pregnancy in dairy cows. The Veterinary Journal 195, 385–387.
Baumgard LH, Collier RJ and Bauman DE (2017) A 100-year review: regulation of nutrient partitioning to support lactation. Journal of Dairy Science 100, 10353–10366.
Bell AW and Bauman DE (1997) Adaptations of glucose metabolism during pregnancy and lactation. Journal of Mammary Gland Biology and Neoplasia 2, 265–278.
Bernabucci U, Ronchi B, Lacetera N and Nardone A (2002) Markers of oxidative status in plasma and erythrocytes of transition dairy cows during hot season. Journal of Dairy Science 85, 2173–2179.
Bernabucci U, Ronchi B, Lacetera N and Nardone A (2005) Influence of body condition score on relationships between metabolic status and oxidative stress in periparturient dairy cows. Journal of Dairy Science 88, 2017–2026.
Blavy P, Derks M, Martin O, Hoglund JK and Friggens NC (2016) Overview of progesterone profiles in dairy cows. Theriogenology 86, 1061–1071.
Boor KJ, Wiedmann M, Murphy S and Alcaine S (2017) A 100-year review: microbiology and safety of milk handling. Journal Dairy Science 100, 9933–9951.
Bordignon M, Da DAlt L, Marinelli L and Gabai G (2014) Advanced oxidation protein products are generated by bovine neutrophils and inhibit free radical production in vitro. Veterinary Journal 199, 162–168.
Boschetti E, Hernández-Castellano LE and Righetti PG (2019) Progress in farm animal proteomics: the contribution of combinatorial peptide ligand libraries. Journal of Proteomics 197, 1–13.
Bradford BJ, Yuan K, Farney JK, Mamedova LK and Carpenter AJ (2015) Invited review: inflammation during the transition to lactation: new adventures with an old flame. Journal of Dairy Science 98, 6631–6650.
Bruinjé TC, Colazo MG, Gobikrushnth M and Ambrose DJ (2017a) Relationships among early postpartum luteal activity, parity, and insemination outcomes based on in-line milk progesterone profiles in Canadian Holstein cows. Theriogenology 100, 32–41.
Bruinjé TC, Gobikrushnth M, Colazo MG and Ambrose DJ (2017b) Dynamics of pre- and post-insemination progesterone profiles and insemination outcomes determined by an in-line milk analysis system in primiparous and multiparous Canadian Holstein cows. Theriogenology 102, 147–153.
Burfeind O, Bruins M, Bos A, Sannmann I, Voigtsberger R and Heuwieser W (2014) Diagnosis of acute puerperal metritis by electronic nose device analysis of vaginal discharge in dairy cows. Theriogenology 82, 64–70.
Caja G, Castro-Costa A and Knight CH (2016) Engineering to support wellbeing of dairy animals. Journal of Dairy Research 83, 136–147.
Celi P (2010) The role of oxidative stress in small ruminants’ health and production. Brazilian Journal of Animal Science 39, 348–363.
Celi P and Gabai G (2015) Oxidant/antioxidant balance in animal nutrition and health: the role of protein oxidation. Frontiers in Veterinary Science 2, 1–13.
Celi P, Merlo M, Da Dalt L, Stefani A, Barbato O and Gabai G (2011) Relationship between late embryonic mortality and the increase in plasma advanced oxidised protein products (AOPP) in dairy cows. Reproduction, Fertility and Development 23, 527–533.
Celli P and Raadsma HW (2010) Effects of Yerba Mate (Ilex paraguariensis) supplementation on the productive performance of dairy cows during mid–lactation. Animal Production Science 50, 339–344.
Chagunda MG, Friggens NC, Rasmussen MD and Larsen T (2006) A model for detection of individual cow mastitis based on an indicator measured in milk. Journal of Dairy Science 89, 2980–2998.
Chapinal N, LeBlanc SJ, Carson ME, Leslie KE, Godden S, Capel M, Santos JEP, Overton MV and Duffield TF (2012) Herd-level association of serum metabolites in the transition period with disease, milk production, and early lactation reproductive performance. Journal of Dairy Science 95, 5676–5682.
Damm M, Holm C, Blaabjerg M, Bro MN and Schwarz D (2017) Differential somatic cell count – a novel method for routine mastitis screening in the frame of Dairy Herd Improvement testing programs. Journal of Dairy Science 100, 4926–4940.
Danscher AM, Li SC, Andersen PH, Khafipour E, Kristensen NB and Plaizier JC (2015) Indicators of induced subacute ruminal acidosis (SARA) in Danish Holstein cows. Acta Veterinaria Scandinavica 57, 39.
de Boer MW, LeBlanc SJ, Dubuc J, Meier S, Heuwieser W, Arlt S, Gilber RO and McDougall S (2014) Systematic review of diagnostic tests for reproductive-tract infection and inflammation in dairy cows. Journal of Dairy Science 97, 3983–3999.
Douphrate DI, Hagevoort GR, Nonnenmann MW, Lunner Kolstrup C, Reynolds SJ, Jakob M and Kinsel M (2013) The dairy industry: a brief description of production practices, trends, and farm characteristics around the world. Journal of Agromedicine 18, 187–197.
Drackley JK (1999) ADSA Foundation Scholar Award. Biology of dairy cows during the transition period: the final frontier? Journal of Dairy Science 82, 2259–2273.
Duffield TF, Lissemore KD, Mcbride BW and Leslie KE (2009) Impact of hyperketonemia in early lactation dairy cows on health and production. Journal of Dairy Science 92, 571–580.
Duncan AJ, Teufel N, Mekonnen K, Singh VK, Bitew A and Gebremedhin B (2013) Dairy intensification in developing countries: effects of market quality on farm-level feeding and breeding practices. Animal: An International Journal of Animal Bioscience 7, 2054–2062.
Duplessis M, Santschi DE, Plante S, Bergeron C, Lefebvre DM, Durocher J and Cue RI (2019) Milk β-hydroxybutyrate concentration measured by Fourier-transform infrared and flow-injection analyses from samples taken at different times relative to milking. Journal of Dairy Research 86, 208–210.
Esposito G, Irons PC, Webb EC and Chapwanya A (2014) Interactions between negative energy balance, metabolic diseases, uterine health and immune response in transition dairy cows. Animal Reproduction Science 144, 60–71.
Essl A (1998) Longevity in dairy cattle breeding: a review. Livestock Production Science 57, 79–89.
Ewaschuk JB, Naylor JM and Zello GA (2005) D-lactate in human and ruminant metabolism. Journal of Nutrition 135, 1619–1625.
Faulkner A, Chaiyabutr N, Peaker M, Carrick DT and Kuhn NJ (1981) Metabolic significance of milk glucose. Journal of Dairy Research 48, 51–56
Friederick M and Holtz W (2010) Establishment of an ELISA for measuring bovine pregnancy-associated glycoprotein in serum or milk and its application for early pregnancy detection. Reproduction in Domestic Animals 45, 142–146.
Friggens NC and Chagunda MGG (2005) Prediction of the reproductive status of cattle on the basis of milk progesterone measures: model description. Theriogenology 64, 155–190.
Friggens NC, Bjerring M, Ridder C, Højsgaard S and Larsen T (2008) Improved detection of reproductive status in dairy cows using milk progesterone measurements. Reproduction in Domestic Animals 43(suppl. 2), 113–121.
Gabai G, Amadori M, Knight CH and Werling D (2018) The immune system is part of a whole-organism regulatory network. Research in Veterinary Science 116, 1–3.
Gautam G, Nakao T, Yamada K and Yoshida C (2010) Defining resumption of ovarian activity postpartum and its impact on subsequent reproductive performances in Holstein cows. Theriogenology 73, 180–189.
Geishauser T, Leslie K, Kelton D and Duffield T (1998) Evaluation of five cowside tests for use with milk to detect subclinical ketosis in dairy cows. Journal of Dairy Science 81, 438–443.
Green MP, Hunter MG and Mann GE (2005) Relationships between maternal hormone secretion and embryo development on day 5 of pregnancy in dairy cows. Animal Reproduction Science 88, 179–189.
Gross J, van Dorland HA, Bruckmaier RM and Schwarz FJ (2011) Milk fatty acid profile related to energy balance in dairy cows. Journal of Dairy Research 78, 479–488.
Guzzo N, Balloni L, Mantovani R, Da Dalt I and Gabai G (2015) Oxidized protein biomarkers in the blood and milk of cows supplemented with flaxseed during the dry period. In Knight CH (ed.), 2nd DairyCare Conference March 3–4. Cordoba Spain-DairyCare COST Action FA1308, p. 60.
Halachmi I and Guarino M (2016) Editorial: precision livestock farming: a ‘per animal’ approach using advanced monitoring technologies. Animal: An International Journal of Animal Bioscience 10, 1482–1483.
Halachmi I, Guarino M, Bewley J and Pastell M (2019) Smart animal agriculture: application of real-time sensors to improve animal well-being and production. Annual Review of Animal Biosciences 7, 403–425.
Halasa T, Huijps K, Osteras O and Hogeveen H (2007) Economic effects of bovine mastitis and mastitis management: a review. Veterinary Quarterly 29, 18–31.
Harmon RJ, Lu M, Trammel DS and Smith BA (1997) Influence of heat stress and calving on antioxidant activity in bovine blood. Journal of Dairy Science 80(suppl. 1), 264
Hart CG, Camacho LE, Swanson KC, Vonnahme KA and Lemley CO (2014) Hepatic steroid metabolizing enzyme activity during early, mid, and late bovine pregnancy. Domestic Animal Endocrinology 49, 31–38.
Haugejorden G, Waage S, Dahl E, Karlberg K, Beckers JF and Ropstad E (2006) Pregnancy associated glycoproteins (PAG) in postpartum cows, ewes, goats and their offspring. Theriogenology 66, 1976–1984.
Hernández-Castellano LE, Torres A, Alavoine A, Ruiz-Diaz MD, Arguello A, Capote J and Castro N (2011) Effect of milking frequency on milk immunoglobulin concentration (IgG, IgM and IgA) and chitotriosidase activity in Majorera goats. Small Ruminant Research 98, 70–72.
Hernández-Castellano LE, Almeida AM, Renaut J, Arguello A and Castro N (2016a) A proteomics study of colostrum and milk from the two major small ruminant dairy breeds from the Canary Islands: a bovine milk comparison perspective. Journal of Dairy Research 83, 366–374.
Hernández-Castellano LE, Ferreira AM, Nanni P, Grossmann J, Argüello A, Capote J, Cai G, Lippolis J, Castro N and de Almeida AM (2016b) The goat (Capra hircus) mammary gland secretory tissue proteome as influenced by weight loss: a study using label free proteomics. Journal of Proteomics 145, 60–69.
Hernández-Castellano LE, Wall SK, Stephan R, Corti S and Bruckmaier R (2017a) Milk somatic cell count, lactate dehydrogenase activity, and immunoglobulin G concentration associated with mastitis caused by different pathogens: a field study. Schweizer Archiv für Tierheilkunde 159, 283–290.
Hernández-Castellano LE, Hernández LL, Weaver S and Bruckmaier RM (2017b) Increased serum serotonin improves parturient calcium homeostasis in dairy cows. Journal of Dairy Science 100, 1580–1587.
Hernández-Castellano LE, Nally JE, Lindahl J, Wanapat M, Alhidary IA, Fangueiro D, Grace D, Ratto M, Bambou JC and de Almeida AM (2019) Dairy science and health in the tropics: challenges and opportunities for the next decades. Tropical Animal Health and Production 51, 1009–1017.
Horst RL, Goff JP, Reinhardt TA and Buxton DR (1997) Strategies for preventing milk fever in dairy cattle. Journal of Dairy Science 80, 1269–1280.
Imhasly S, Bieli C, Naegeli H, Nyström L, Ruetten M and Gerspach C (2015) Blood plasma lipidome profile of dairy cows during the transition period. BMC Veterinary Research 11, 252
Jones G, Bork O, Ferguson SA and Bates A (2019) Comparison of an on-farm point-of-care diagnostic with conventional culture in analyzing bovine mastitis samples. Journal of Dairy Research 86, 222–225.
Kappel ND, Proll F and Gauglitz G (2007) Development of a TIRF-based biosensor for sensitive detection of progesterone in bovine milk. Biosensors and Bioelectronics 22, 2295–2300.
Kasimanickam R, Duffield TF, Foster RA, Gartley CJ, Leslie KE, Walton JS and Johnson WH (2004) Endometrial cytology and ultrasonography for the detection of subclinical endometritis in postpartum dairy cows. Theriogenology 62, 9–23.
Katsafadou AI, Tsangaris GT, Billinis C and Fthenakis GC (2015) Use of proteomics in the study of microbial diseases of small ruminants. Veterinary Microbiology 181, 27–33.
Koeck A, Jamrozik J, Schenkel FS, Moore RK, Lefebvre DM, Kelton DF and Miglior F (2014) Genetic analysis of milk beta-hydroxybutyrate and its association with fat-to-protein ratio, body condition score, clinical ketosis, and displaced abomasum in early first lactation of Canadian Holsteins. Journal of Dairy Science 97, 7286–7292.
Koolhaas JM and van Reenen CG (2016) Interaction between coping style/ personality, stress, and welfare: relevance for domestic farm animals. Journal of Animal Science 94, 2284–2296.
Kusebauch U, Hernández-Castellano LE, Bislev SL, Moritz RL, Rontved CM and Bendixen E (2018) Selected reaction monitoring mass spectrometry of mastitis milk reveals pathogen-specific regulation of bovine host response proteins. Journal of Dairy Science 101, 6532–6541.
Kou L, Zhang D and Liu D (2017) A novel medical e-nose signal analysis system. Sensors 17, 402.
Lamming GE and Darwash AO (1998) The use of milk progesterone profiles to characterise components of subfertility in milked dairy cows. Animal Reproduction Science 52, 175–190.
Larsen T (2017) Fluorometric determination of D-lactate in biological fluids. Analytical Biochemistry 539, 152–157.
Larsen T and Moyes KM (2015) Are free glucose and glucose-6-phosphate in milk indicators of specific physiological states in the cow? Animal: An International Journal of Animal Bioscience 9, 86–93.
Lawson BC, Shahzad AH, Dolecheck KA, Martel EL, Velek KA, Ray DL, Lawrence JC and Silva WJ (2014) A pregnancy detection assay using milk samples: evaluations and considerations. Journal of Dairy Science 97, 6316–6325.
LeBlanc S (2013) Field evaluation of a pregnancy confirmation test using milk samples in dairy cows. Journal of Dairy Science 96, 2345–2348.
Lemann J Jr, Bushinsky DA and Hamm LL (2003) Bone buffering of acid and base in humans. American Journal of Physiology-Renal Physiology 285, F811–F832
Lemberskiy-Kuzin L, Lavie S, Katz G, Merin U and Leitner G (2019) Determination of immunoglobulins levels in colostrum by using an on-line milk analyzer. Canadian Journal of Animal Science 99, 631–633.
Lemley CO and Wilson ME (2010) Effect of cytochrome P450 and aldo-keto reductase inhibitors on progesterone inactivation in primary bovine hepatic cell cultures. Journal of Dairy Science 93, 4613–4624.
Lemley CO, Vonnahme KA, Tager LR, Krause KM and Wilson ME (2011) Diet-induced alterations in hepatic progesterone (P4) catabolic enzyme activity and P4 clearance rate in lactating dairy cows. Journal of Endocrinology 205, 233–241.
Ling T, Hernández-Jover M, Sordillo LM and Abuelo A (2018) Maternal lategestation metabolic stress is associated with changes in immune and metabolic responses of dairy calves. Journal of Dairy Science 101, 6568–6580.
Magro M, Zaccarin M, Miotto G, Da Dalt L, Baratella D, Fariselli P, Gabai G and Vianello F (2018) Analysis of hard protein corona composition on selective ironoxide nanoparticles by MALDI-TOF mass spectrometry: identification and amplification of a hidden mastitis biomarker in milk proteome. Analytical and Bioanalytical Chemistry 410, 2949–2959.
Martin NP, Russelle MP, Powell JM, Sniffen CJ, Smith SI, Tricarico JM and Grant RJ (2017) Invited review: sustainable forage and grain crop production for the US dairy industry. Journal of Dairy Science 100, 9479–9494.
Mavangira V and Sordillo LM (2018) Role of lipid mediators in the regulation of oxidative stress and inflammatory responses in dairy cattle. Research in Veterinary Science 116, 4–14.
Mavangira V, Mangual MJ, Gandy JC and Sordillo LM (2016) 15-F2t-isoprostane concentrations and oxidant status in lactating dairy cattle with acute coliform mastitis. Journal of Veterinary Internal Medicine 30, 339–347.
Mazeris F (2010) DeLaval Herd Navigator® proactive herd management. The First North American Conference on Precision Dairy Management, March 2010, Toronto, Can. Available at http://www.precisiondairy.com/proceedings/s1mazeris.pdf.
McArt JAA, Nydam DV, Oetzel GR, Overton TR and Ospina PA (2013) Elevated non-esterified fatty acids and β-hydroxybutyrate and their association with transition dairy cow performance. The Veterinary Journal 198, 560–570.
McGuffey RK (2017) A 100-year review: metabolic modifiers in dairy cattle nutrition. Journal of Dairy Science 100, 10113–10142.
McNeill RE, Diskin MG, Sreenan JM and Morris DG (2006) Associations between milk progesterone concentration on different days and with embryo survival during the early luteal phase in dairy cows. Theriogenology 65, 1435–1441.
Medhammar E, Wijesinha-Bettoni R, Stadlmayr B, Nilsson E, Charrondiere UR and Burlingame B (2012) Composition of milk from minor dairy animals and buffalo breeds: a biodiversity perspective. Journal of the Science of Food and Agriculture 92, 445–474.
Sousa N M, Tchimbou AF and Beckers JF (2015) Development of a new immunoradiometric assay for pregnancy-associated glycoproteins (IRMA-PAG) allowing pregnancy follow-up in cattle by using milk samples. Final OptiMIR Scientific and Expert Meeting: From milk analysis to advisory tools (Palais des Congrès, Namur, Belgium, 16–17 April 2015). Biotechnology, Agronomy, Society and Environment 19, 120.
Möller R, Dannenberger D, Nürnberg G, Strucken E-M and Brockmann GA (2019) Relationship between the fatty acid profile of hair and energy availability of lactating primiparous cows. Journal of Dairy Research 86, 77–84.
Moyes KM, Larsen T, Friggens NC, Drackley JR and Ingvartsen KL (2009) Identification of potential markers in blood for the development of subclinical and clinical mastitis in dairy cattle at parturition and during early lactation. Journal of Dairy Science 92, 5419–5428.
Mudaliar M, Tassi R, Thomas FC, McNeilly TN, Weidt SK, McLaughlin M, Wilson D, Burchmore R, Herzyk P, Eckersall PD and Zadoks RN (2016) Mastitomics, the integrated omics of bovine milk in an experimental model of Streptococcus uberis mastitis: 2. Label-free relative quantitative proteomics. Molecular Biosystems 12, 2748–2761.
Neubauer V, Humer E, Kroger I, Braid T, Wagner M and Zebeli Q (2018) Differences between pH of indwelling sensors and the pH of fluid and solid phase in the rumen of dairy cows fed varying concentrate levels. Journal of Animal Physiology and Animal Nutrition 102, 343–349.
Nogalski Z, Wroski M, Sobczuk-Szul M, Mochol M and Pogorzelska P (2012) The effect of body energy reserve mobilization on the fatty acid profile of milk in high-yielding cows. Asian-Australasian Journal of Animal Science 25, 1712–1720.
Nyman AK, Persson Waller K, Bennedsgaard TW, Larsen T and Emanuelson U (2014) Associations of udder-health indicators with cow factors and with intramammary infection in dairy cows. Journal of Dairy Science 97, 5459–5473.
Oku Y, Osawa T, Hirata T-I, Kon N, Akasaka S, Senosy WS, Takahashi T and Izaike Y (2011) Validation of a direct time-resolved fluoroimmunoassay for progesterone in milk from dairy and beef cows. The Veterinary Journal 190, 244–248.
Ospina PA, Nydam DV, Stokol T and Overton TR (2010) Association between the proportion of sampled transition cows with increased nonesterified fatty acids and β-hydroxybutyrate and disease incidence, pregnancy rate, and milk production at the herd level. Journal of Dairy Science 93, 3595–3601.
Ospina PA, McArt JA, Overton TR, Stokol T and Nydam DV (2013) Using nonesterified fatty acids and β-hydroxybutyrate concentrations during the transition period for herd-level monitoring of increased risk of disease and decreased reproductive and milking performance. Veterinary Clinics of North America: Food Animal Practice 29, 387–412.
Patbandha TK, Ravikala K, Maharana BR, Marandi S, Ahlawat AR and Gajbhiya PU (2015) Effect of season and stage of lactation on milk components of Jaffrabadi Buffaloes. The Bioscan 10, 635–638.
Polsky LM and von Keyserlingk AG (2017) Invited review: effects of heat stress on dairy cattle welfare. Journal of Dairy Science 100, 8645–8657. Posthuma-Trumple GA, van Amerongen A, Korf J and van Berkel WJH (2009) Prospectives for on-site monitoring of progesterone. Trends in Biotechnology 27, 652–660.
Pulina G, Milán MJ, Lavín MP, Theodoridis A, Morin E, Capote J, Thomas DL, Francesconi AHD and Caja G (2018) Current production trends, farm structures, and economics of the dairy sheep and goat sectors. Journal of Dairy Science 101, 6715–6729.
Raboisson D, Barbier M and Maigné E (2016) How metabolic diseases impact the use of antimicrobials: a formal demonstration in the field of veterinary medicine. PLoS One 11, e0164200.
Ranasinghe RMSBK, Nakao T, Yamada K, Koike K, Hayashi A and Dematawewa CMB (2011) Characteristics of prolonged luteal phase identified by milk progesterone concentrations and its effects on reproductive performances in Holstein cows. Journal of Dairy Science 94, 116–127.
Rhinehart JD, Starbuck-Clemmer MJ, Flores JA, Milvae RA, Yao J, Poole DH and Inskeep EK (2009) Low peripheral progesterone and late embryonic/ early fetal loss in suckled beef and lactating dairy cows. Theriogenology 71, 480–490.
Roche JR, Berry DP, Bryant AM, Burke CR, Butler ST, Dillon PG, Donaghy DJ, Horan B, Macdonald KA and Macmillan KL (2017) A 100-year review: a century of change in temperate grazing dairy systems. Journal of Dairy Science 100, 10189–10233.
Rojo-Gimeno C, Fievez V and Wauters E (2018) The economic value of information provided by milk biomarkers under different scenarios: casestudy of an ex-ante analysis of fat-to-protein ratio and fatty acid profile to detect subacute ruminal acidosis in dairy cows. Livestock Science 211, 30–41.
Rukkwamsuk T, Geelen MJ, Kruip TA and Wensing T (2000) Interrelation of fatty acid composition in adipose tissue, serum, and liver of dairy cows during the development of fatty liver postpartum. Journal of Dairy Science 83, 52–59.
Saint-Dizier M and Chastant-Maillard S (2012) Towards an automated detection of oestrus in dairy cattle. Reproduction in Domestic Animals 47, 1056–1061.
Sangsritavong S, Combs DK, Sartori R, Armentano LE and Wiltbank MC (2002) High feed intake increases liver blood flow and metabolism of progesterone and estradiol-17beta in dairy cattle. Journal of Dairy Science 85, 2831–2842.
Sannmann I, Burfeind O, Suthar V, Bos A, Bruins M and Heuwieser W (2013) Technical note: evaluation of odor from vaginal discharge of cows in the first 10 days after calving by olfactory cognition and an electronic device. Journal of Dairy Science 96, 5773–5779.
Santos JEP, Rutigliano HM and Sa Filho MF (2009) Risk factors for resumption of postpartum estrous cycles and embryonic survival in lactating dairy cows. Animal Reproduction Science 110, 207–221.
Schukken YH, Wilson DJ, Welcome F, Garrison-Tikofsky L and Gonzalez RN (2003) Monitoring udder health and milk quality using somatic cell counts. Veterinary Research 34, 579–596.
Scott RA, Beuman DE and Clark JH (1976) Cellular gluconeogenesis by lactating bovine mammary tissue. Journal of Dairy Science 59, 50–56.
Shacter E (2000) Quantification and significance of protein oxidation in biological samples. Drug Metabolism Reviews 32, 307–326.
Sheldon IM, Price SB, Cronin J, Gilbert RO and Gadsby JE (2009) Mechanisms of infertility associated with clinical and subclinical endometritis in high producing dairy cattle. Reproduction in Domestic Animals 44 (suppl. 3), 1–9
Sordillo LM, Contreras GA and Aitken SL (2009) Metabolic factors affecting the inflammatory response of periparturient dairy cows. Animal Health Research Reviews 10, 53–63.
Spears JW and Weiss WP (2008) Role of antioxidants and trace elements in health and immunity of transition dairy cows. The Veterinary Journal 176, 70–76.
Starbuck GR, Gutierrez CG, Peters AR and Mann GE (2006) Timing of follicular phase events and the postovulatory progesterone rise following synchronization of oestrus in cows. The Veterinary Journal 172, 103–108.
Stoop WM, Bovenhuis H, Heck JML and van Arendonk JAM (2009) Effect of lactation stage and energy status on milk fat composition of Holstein-Friesian cows. Journal of Dairy Science 92, 1469–1478.
Stronge AJH, Sreenan JM, Diskin MG, Mee JF, Kenny DA and Morris DG (2005) Post-insemination milk progesterone concentration and embryo survival in dairy cows. Theriogenology 64, 1212–1224.
Szenci O, Humblot P, Beckers JF, Sasser G, Sulon J, Baltusen R, Varga J, Bajcsy CSA and Taverne MAM (2000) Plasma profiles of progesterone and conceptus proteins in cows with spontaneous embryonic/fetal mortality as diagnosed by ultrasonography. The Veterinary Journal 159, 287–290.
Tan C, Bian C, Yang D, Li N, Wu ZF and Hu XX (2017) Application of genomic selection in farm animal breeding. Yi Chuan 39, 1033–1045.
Tedde V, Bronzo V, Puggioni GMG, Pollera C, Casula A, Curone G, Moroni P, Uzzau S and Addis MF (2019) Milk cathelicidin and somatic cell counts in dairy goats along the course of lactation. Journal of Dairy Research 86, 217–221.
Thilsing-Hansen T, Jorgensen RJ and Ostergaard S (2002) Milk fever control principles: a review. Acta Veterinaria Scandinavica 43, 1–19.
Thomas FC, Mudaliar M, Tassi R, McNeilly TN, Burchmore R, Burgess K, Herzyk P, Zadoks RN and Eckersall PD (2016a) Mastitomics, the integrated omics of bovine milk in an experimental model of Streptococcus uberis mastitis: 3. Untargeted metabolomics. Molecular Biosystems 12, 2762–2769.
Thomas FC, Mullen W, Tassi R, Ramirez-Torres A, Mudaliar M, McNeilly TN, Zadoks RN, Burchmore R and David Eckersall P (2016b) Mastitomics, the integrated omics of bovine milk in an experimental model of Streptococcus uberis mastitis: 1. High abundance proteins, acute phase proteins and peptidomics. Molecular Biosystems 12, 2735–2747.
Toledo-Alvarado H, Vazquez AI, de los Campos G, Tempelman RJ, Gabai G, Cecchinato A and Bittante G (2018) Changes in milk characteristics and fatty acid profile during the estrous cycle in dairy cows. Journal of Dairy Science 101, 9135–9153.
van Knegsel ATM, van den Brand H, Dijkstra J, Tamminga S and Kemp B (2005) Effect of dietary energy source on energy balance, production, metabolic disorders and reproduction in lactating dairy cattle. Reproduction Nutrition Development 45, 665–688.
Vasileiou NGC, Chatzopoulos DC, Sarrou S, Fragkou IA, Katsafadou AI, Mavrogianni VS, Petinaki E and Fthenakis GC (2019) Role of staphylococci in mastitis in sheep. Journal of Dairy Research 86, 254–266.
Veronesi MC, Gabai G, Battocchio M, Mollo A, Soldano F, Bono G and Cairoli F (2002) Ultrasonographic appearance of tissue is a better indicator of CL function than CL diameter measurement in dairy cows. Theriogenology 58, 61–68.
Vlček M, Žitný J and Kasarda R (2016) Changes of fat-to-protein ratio from start to the midlactation and the impact on milk yield. Journal of Central European Agriculture 17, 1194–1203.
Wall SK, Hernández-Castellano LE, Ahmadpour A, Bruckmaier RM and Wellnitz O (2016a) Differential glucocorticoid-induced closure of the blood-milk barrier during lipopolysaccharide- and lipoteichoic acidinduced mastitis in dairy cows. Journal of Dairy Science 99, 7544–7553.
Wall SK, Wellnitz O, Hernández-Castellano LE, Ahmadpour A and Bruckmaier RM (2016b) Superphysiological oxytocin increases the transfer of immunoglobulins and other blood components to milk during lipopolysaccharide- and lipoteichoic acid-induced mastitis in dairy cows. Journal of Dairy Science 99, 9165–9173.
Wall SK, Wellnitz O, Bruckmaier RM and Schwarz D (2018) Differential somatic cell count in milk before, during, and after lipopolysaccharideand lipoteichoic-acid-induced mastitis in dairy cows. Journal of Dairy Science 101, 5362–5373.
Wallace RM, Pohler KG, Smith MF and Green JA (2015) Placental PAGs: gene origins, expression patterns, and use as marker of pregnancy. Reproduction 149, R115–R126.
Walsh SW, Williams EJ and Evans ACO (2011) A review of the causes of poor fertility in high milk producing dairy cows. Animal Reproduction Science 123, 127–138.
Weaver SR, Prichard AS, Maerz NL, Prichard AP, Endres EL, Hernández-Castellano LE, Akins MS, Bruckmaier RM and Hernández LL (2017) Elevating serotonin pre-partum alters the Holstein dairy cow hepatic adaptation to lactation. PLoS One 12, e0184939.
Xu YF, Velasco-Garcia M and Mottram TT (2005) Quantitative analysis of the response of an electrochemical biosensor for progesterone in milk. Biosensors and Bioelectronics 20, 2061–2070.
Xu X, Liang F, Shi J, Zhao X, Liu Z, Wu L, Song Y, Zhang H and Wang Z (2013) Determination of hormones in milk by hollow fiber-based stirring extraction bar liquid–liquid microextraction gas chromatography mass spectrometry. Analytica Chimica Acta 790, 39–46.
Zachut M, Kra G, Portnik Y, Shapiro F and Silanikove N (2016) Milk glucose-6-phosphate dehydrogenase activity and glucose-6-phosphate are associated with oxidative stress and serve as indicators of energy balance in dairy cows. Royal Society of Chemistry Advances 6, 65412–65417.
Zachut M, Kra G, Livshitz L, Portnick Y, Yakoby S, Friedlander G and Levin Y (2017) Seasonal heat stress affects adipose tissue proteome toward enrichment of the Nrf2-mediated oxidative stress response in late-pregnant dairy cows. Journal of Proteomics 158, 52–61.
Zarrin M, De Matteis L, Vernay MC, Wellnitz O, van Dorland HA and Bruckmaier RM (2013) Long-term elevation of beta-hydroxybutyrate in dairy cows through infusion: effects on feed intake, milk production, and metabolism. Journal of Dairy Science 96, 2960–2972.
Zhao F-Q (2014) Biology of glucose transport in the mammary gland. Journal of Mammary Gland Biology and Neoplasia 19, 3–17.
DOI: doi.org/10.1017/S0022029920000084