Sintesi
Nel corso di questo progetto è stato sviluppato e validato un metodo analitico multiclasse in Cromatografia Liquida accoppiata alla spettrometria di massa tandem (LC-MS/MS) per la determinazione quantitativa in alimenti ad uso zootecnico (AUZ) di 19 principi attivi appartenenti alle seguenti famiglie di antibiotici: beta-lattamici, macrolidi, pleuromutiline, amfenicoli, lincosamidi, diaminopirimidine. E’ stato ottimizzato il metodo di preparazione dei campioni di mangime per la determinazione a livello di carry-over di quelle famiglie di antibiotici per cui il laboratorio non disponeva ancora di metodi accreditati in uso. Il metodo è stato validato come metodo quantitativo di conferma; sono stati verificati con esito soddisfacente gli indici di prestazione quali linearità della risposta, Limite di Quantificazione (LOQ), esattezza, precisione, robustezza e incertezza di misura. Questo metodo analitico potrà essere utilizzato nei controlli ufficiali previsti dal Piano Nazionale Alimentazione Animale (PNAA) per la determinazione quantitativa di antibiotici nei mangimi a livello di carry-over.
Introduzione
I prodotti destinati all’alimentazione animale possono contenere sostanze indesiderabili, in grado di nuocere non solo alla salute degli animali ma anche a quella umana [1,2]. Rilevante è la presenza nei mangimi di antibiotici, anche a livelli sub-terapeutici, per le pesanti conseguenze che può avere sulla sicurezza alimentare e sull’insorgenza di fenomeni di antibiotico-resistenza. E’ frequente nelle industrie mangimistiche che nella stessa linea di produzione siano fabbricati consecutivamente mangimi medicati e non medicati: può quindi accadere che mangimi non medicati che escono dalla stessa linea di produzione rechino inevitabilmente tracce del farmaco usato precedentemente. Questo trasferimento da un lotto di produzione a un altro è detto carry-over ed è stato ampiamente studiato al fine di poter attuare efficaci misure di controllo [3]. Nessun Regolamento Comunitario ad oggi fissa, per i farmaci autorizzati, tenori massimi accettabili per effetto di carry-over inevitabile, in modo da armonizzare i controlli tra gli Stati Membri e la decisione di non-conformità dei campioni. Nel 2015 è stato finanziato e condotto il progetto congiunto Ministero – C.Re.A.A. – Assalzoo “CROSS: Carryover Stato dell’arte Mangimifici Italia“, per verificare il fenomeno del carry-over da tetracicline e sulfamidici. Nel 2015 il Ministero della Salute ha fissato a livello nazionale un valore di LM nei mangimi a seguito di carryover inevitabile pari a 0.5 mg/kg per penicilline e 1 mg/kg per gli altri antibiotici. Le nuove indicazioni hanno portato allo sviluppo di questo progetto con lo scopo di ottimizzare e validare un metodo analitico multiclasse [4,5] quantitativo nei mangimi a livello di carry-over per quelle famiglie di antibiotici per cui il laboratorio non disponeva di metodi accreditati in uso e che potesse essere usato nei controlli ufficiali previsti dal PNAA.
Materiale e metodi
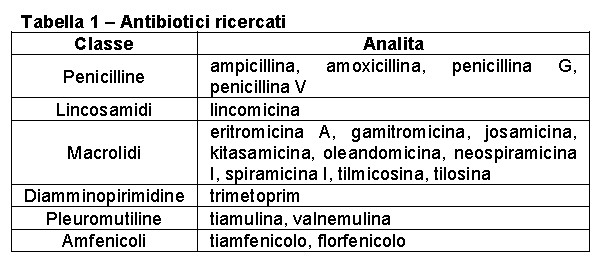
Sono state preparate le soluzioni madre di tutti gli analiti e gli standard interni alla concentrazione di 200 ng/μl e da queste, per diluizione, le soluzioni di drogaggio a 10 ng/μl per gli analiti e 20 ng/μl per gli standard interni. La tabella 1 riporta gli antibiotici ricercati.
Il campione di mangime è stato pesato e sottoposto a doppia estrazione, l’estratto portato a secco e il residuo ripreso con una soluzione di ammonio formiato 5 mM acquoso/ acetonitrile (95:5 v/v). Dopo centrifugazione, il surnatante è stato trasferito in vials per l’analisi LC-MS/MS. L’analisi strumentale è stata eseguita su uno spettrometro di massa a triplo quadrupolo in modalità MRM; per tutti gli analiti sono state determinate le 4 transizioni migliori e le corrispondenti energie di collisione. Il LOQ è stato fissato a 0.25 mg/kg per le penicilline e 0.50 mg/kg per gli altri analiti, corrispondente a metà del LM richiesto. La specificità del metodo è stata valutata processando 25 differenti campioni bianchi di mangimi delle varie specie (bovini, equini, suini, ovicaprini, avicoli, conigli, acquacoltura) e verificando l’assenza di interferenti di matrice nell’intervallo di tempo di ritenzione ± 2.5% rispetto al tempo di ritenzione dell’analita nel controllo positivizzato di seduta. La linearità della risposta strumentale è stata verificata sia su retta di taratura in solvente a 4 livelli di concentrazione per gli analiti (10 – 20 – 40 – 60 pg/ul per penicilline, 20 – 40 – 80 – 120 pg/ul per gli altri analiti) e 40 pg/μl per gli S.I sia su retta in matrice “ante” a 3 livelli di concentrazione (250, 500 e 750 μg/kg per penicilline, 500, 1000 e 1500 μg/kg per gli altri analiti) e 500 μg/kg per gli S.I.. Per ogni punto sono state ripetute 3 iniezioni. Per la valutazione dell’esattezza, della precisione e del limite di ripetibilità del metodo, è stato preparato un pool di matrici bianche composto da mangimi completi per suinetti, polli e conigli. Sono state eseguite le prove in 2 sedute analitiche su campioni fortificati con tutti gli analiti a 3 livelli di concentrazione (250, 500 e 750 μg/kg per penicilline e 500, 1000 e 1500 μg/kg per gli altri analiti), 6 repliche indipendenti per ogni livello. La robustezza del metodo è stata valutata mediante l’approccio di Youden, eseguendo 8 esperimenti su un campione fortificato con tutti gli analiti, modificando 7 variabili individuate nella esecuzione del metodo. L’incertezza di misura estesa relativa percentuale del risultato (con n = 2, k = 2 e P = 95%) è stata valutata con l’approccio bottom up integrato riportato nella Eurachem Guide. Per valutare l’entità del carry-over nella situazione reale di produzione, si è proceduto al prelievo di 12 campioni di mangimi del primo lotto di produzione successivo ad una produzione di mangime medicato.
Risultati e conclusioni
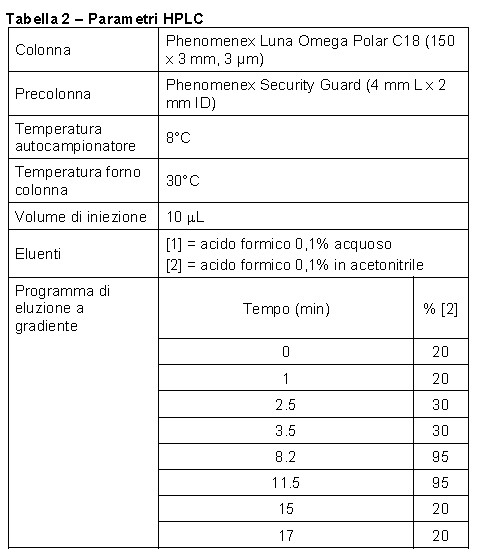
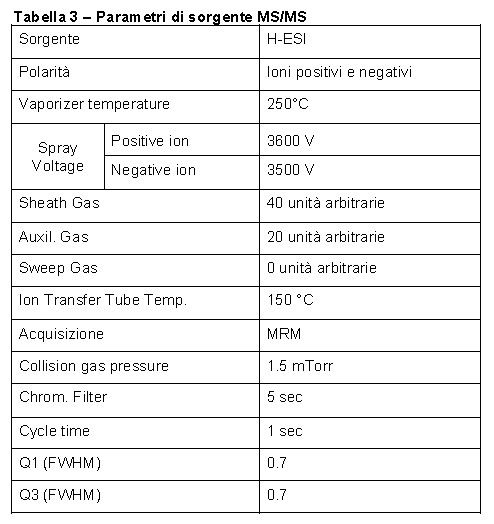
Le tabelle 2 e 3 riportano i parametri ottimizzati per l’analisi HPLC e MS/MS.
Il metodo finale prevede l’estrazione di 4 g di campione con 15 mL di miscela acqua / acetonitrile (20/80 V/V), acidificato allo 0,05% con acido acetico, su agitatore a inversione per 10 minuti, quindi in bagno ad ultrasuoni per 10 minuti, seguita da centrifugazione a 4000 rpm per 10 minuti a 4°C; il surnatante è trasferito in provetta di PP da 50 ml e il residuo estratto con 10 mL di acetonitrile allo 0,05% di acido acetico, su agitatore a inversione per 10 minuti, quindi in bagno ad ultrasuoni per 10 minuti, seguito da centrifugazione a 4000 rpm per 10 minuti a 4°C e unione dei surnatanti. L’estratto è centrifugato a 4000 rpm per 15 minuti a 4°C; 0.5 mL di estratto è portato a secco in bagno termostatico a 45 °C in corrente d’azoto; il residuo è disciolto in 1 mL di miscela ammonio formiato 5 mM / acetonitrile (95 / 5 V/V), centrifugato a 13000 rpm per 15 minuti, quindi trasferito in vial per l’analisi HPLC. Le prove di validazione indicano che la linearità è risultata soddisfacente per tutti gli analiti in quanto l’ R2 è maggiore di 0.998, la dispersione dei fattori di risposta rispetto al valore medio è minore del 10%, limite di rilevabilità Xa è minore del primo punto della curva [6]. Il metodo è in grado di quantificare gli analiti a partire da concentrazioni pari a 0.5 volte il valore di LM (LOQ = 0.25 mg/kg per penicilline e 0.5 mg/kg per gli altri antibiotici). Per la quantificazione si è utilizzata la risposta dell’analita come somma di tutte le transizioni (TIC). Il dato quantitativo si è ottenuto per interpolazione su retta in matrice “ante” costruita come area relativa (TIC analita / TIC S.I.) vs concentrazione corrispondente in matrice. L’esattezza è compresa tra il 90 e il 120% e i valori di CV% di ripetibilità stretta e intermedia sono in accordo con la normativa vigente. La robustezza del metodo è stata valutata mediante approccio di Youden su un campione di mangime fortificato al valore di LM. Poiché dal confronto delle varianze risulta Foss < F tab, si conclude che nessuna delle variabili individuate influenza il risultato finale e pertanto il metodo è robusto. L’incertezza di misura estesa (con k = 2 e P 0 95%) è compresa tra 15 e 21%. Dall’analisi per carry-over dei 12 mangimi prodotti come primo lotto dopo la produzione di mangimi medicati, solo 3 campioni presentano dei residui ma tutti con concentrazioni inferiori al LM. Il metodo di analisi sviluppato è rapido, economico, in grado di analizzare fino a 18 campioni in parallelo in un tempo di analisi di 2 giorni e consente la determinazione quantitativa di 19 antibiotici; risulta idoneo per la determinazione quantitativa di antibiotici nei mangimi a livello di carry-over da utilizzare nei controlli ufficiali previsti dal PNAA.
Bibliografia
1. Regolamento (CE) n. 882/2004 del Parlamento Europeo e del Consiglio del 29 aprile 2004 relativo ai controlli ufficiali intesi a verificare la conformità alla normativa in materia di mangimi e di alimenti e alle norme sulla salute e sul benessere degli animali.
2. Regolamento (CE) n. 152/2009 della Commissione del 27 gennaio 2009 che fissa i metodi di campionamento e di analisi per i controlli ufficiali degli alimenti per gli animali.
3. Regolamento (UE) n. 574/2011 della Commissione, del 16 giugno 2011, che modifica l’allegato I della direttiva 2002/32/CE del Parlamento europeo e del Consiglio per quanto riguarda i livelli massimi di nitrito, melamina, Ambrosia spp. e carry-over di alcuni coccidiostatici e istomonostatici e che consolida gli allegati I e II Testo rilevante ai fini del SEE.
4. Robert, N. Gillard, P.-Y. Brasseur, N. Ralet, M. Dubois, P. Delahaut, Rapid multiresidue and multi-class screening for antibiotics and benzimidazoles in feed by ultra high performance liquid chromatography coupled to tandem mass
spectrometry,Food Control,Volume 50,2015,Pages 509-515.
5. Li J, Ren X, Diao Y, Chen Y, Wang Q, Jin W, Zhou P, Fan Q, Zhang Y, Liu H. Multiclass analysis of 25 veterinary drugs in milk by ultra-high performance liquid chromatography-tandem mass spectrometry. Food Chem. 2018 Aug 15;257:259-264.
6. Dec. 2002/657/CE del 12 agosto 2002 “che attua la direttiva 96/23/CE del Consiglio relativa al rendimento dei metodi analitici e all’interpretazione dei risultati”.
Stato dell’arte dei mangimifci – Indagine sui tenori di antibiotici negli allevamenti ad uso zootecnico a seguito di carry-over inevitabile in produzione
Torres E1, Ostorero F1, Avolio R1, Nappi R1, Abete MC1, Gili M1
1) Istituto Zooprofilattico Sperimentale del Piemonte, Liguria e Valle d’Aosta
Key words: mangimi, antibiotici, LC-MS/MS
Fonte: Istituto Zooprofilattico Sperimentale del Piemonte, Liguria e Valle d’Aosta – “L’IZSPLV E LA RICERCA CORRENTE: Presentazione risultati 2019 dei progetti di ricerca corrente finanziati dal Ministero della Salute”