Riassunto
La gestione della bovina da latte nel periodo di transizione presenta diverse problematiche in quanto connotata da importanti modificazioni ormonali e metaboliche che esitano spesso nello sviluppo di condizioni cliniche patologiche come chetosi subclinica e clinica. Nel peripartum, il fabbisogno energetico richiesto per l’accrescimento fetale e la produzione lattea incrementa esponenzialmente, senza essere adeguatamente soddisfatto dalle riserve energetiche fornite mediante dieta. Per soddisfare le proprie esigenze la bovina modifica il metabolismo, che diviene prettamente catabolico, mediante la mobilizzazione del tessuto muscolare e del tessuto adiposo. Lo scopo di questo studio è stato quello di valutare la variazione della concentrazione plasmatica di acidi grassi correlata ai cambiamenti di β-idrossibutirrato (BHB) ematico durante la prima fase di lattazione al fine di comprendere il metabolismo energetico a diversi livelli di iperchetonemia. Le concentrazioni plasmatiche di acidi grassi sono state valutate attraverso l’uso di cromatografia su strato sottile e tecnica gascromatografica (TLC-GC) in quattro classi lipidiche: acidi grassi liberi (FFA), trigliceridi (TG), esteri del colesterolo (CE) e fosfolipidi (PL). In funzione del BHB ematico, 60 bovine sono state suddivise in 2 gruppi aventi rispettivamente concentrazioni medie di BHB pari a 0.42 mmol/L (sane) e concentrazioni medie uguali a 1.36 mmol/L (malate). Dall’analisi svolta, sono stati individuati 11 acidi grassi con funzione predittiva per lo sviluppo di iperchetonemia.
Cambiamenti metabolici nel periodo di transizione
Il periodo di transizione è definito come l’intervallo di tempo che inizia da tre settimane prima del parto e termina a tre settimane dopo il parto (1). Il termine transizione sottolinea il forte cambiamento metabolico, fisiologico e nutrizionale dovuto alla continua richiesta energetica da parte del feto e della lattogenesi e dal ridotto DMI (Dry Matter Intake) (2). L’energia metabolizzabile richiesta per il sostegno di questi due eventi parafisiologici supera il quantitativo di Mcal ottenute mediante alimentazione. Il fabbisogno elevato si traduce quindi in un bilancio energetico negativo (BEN) (3). In peri-partum, il tessuto adiposo, per far fronte alle innumerevoli richieste, diviene un distretto ad elevata attività catabolica e la mobilitazione delle riserve corporee avviene mediante idrolisi catalizzata da enzimi ormone-sensibili detti lipasi (4). Dall’idrolisi dei trigliceridi, si ottengono substrati ad elevata energia quali acidi grassi non esterificati e glicerolo, come risultato di un aumento della lipolisi e una riduzione della lipogenesi (5). Il profilo degli acidi grassi (fatty acid, FA) plasmatici può riflettere la composizione del tessuto adiposo in termini di acidi grassi; infatti, i principali FA del tessuto adiposo sottocutaneo nelle vacche peripartorienti sono l’Acido Stearico (C18:0), l’Acido Palmitico (C16:0) e l’Acido Oleico (C18:1ω9), acidi grassi presenti in concentrazioni maggiori anche nel flusso ematico (6). Gli acidi grassi presenti nel circolo ematico sono suddivisi in varie classi lipidiche plasmatiche che includono i fosfolipidi (PL), i lipidi neutri (NL) e gli acidi grassi non esterificati (Non-Esterified Fatty Acids; NEFA). La frazione dei NL è composta da monogliceridi, digliceridi, trigliceridi (TG) ed esteri di colesterolo (CE) (7). Le classi lipidiche dei PL e NL, a causa della scarsa idrosolubilità, sono trasportate nel circolo ematico mediante lipoproteine mentre i NEFA sono trasportati dall’albumina sierica e possono essere utilizzati direttamente come fonte di energia dai tessuti o essere assorbiti dal fegato (8,9). Il 15-20% del totale degli NEFA plasmatici subisce un processo di up-take epatico ove si sviluppa il pathway catabolico di ossidazione completa per la produzione di ATP mediante il ciclo dell’acido citrico. Nella matrice mitocondriale avviene la β-ossidazione delle catene idrocarburiche degli acidi grassi, con formazione di unità bi-carboniose associati ad una molecola di Coenzima A (Acetil-CoA) che sono successivamente ossidate tramite il ciclo dell’acido citrico (10). In transizione, ad influenzare negativamente lo svolgimento del processo biochimico, vi è un’elevata attività gluconeogenetica che sottrae l’ossalacetato, necessario al ciclo dell’acido citrico. Ne consegue che gli FA sono trasportati nella matrice mitocondriale ma che, a causa della mancanza dell’intermedio ossalacetato, non subiscono la completa ossidazione (11). In tal modo l’accumulo di acetil-CoA comporta un’eccessiva produzione di corpi chetonici (CC): acetoacetato, β idrossibutirrato e acetone, rilevabili nel sangue, nelle urine e nel latte (12). L’eccessiva produzione di CC può esitare nello sviluppo di un grave disordine metabolico chiamato chetosi, quadro clinico o subclinico caratterizzato dall’accumulo di chetoni oltre i limiti fisiologici. Inoltre, l’Acil-CoA prodotto in eccesso può essere esterificato in trigliceridi. I Tg, così ottenuti, possono essere trasportati nel circolo sanguigno mediante lipoproteine a bassissima densità (VLDL) oppure possono essere immagazzinati nel fegato come fonte energetica velocemente metabolizzabile (triacilgliceroli) (13). La ridotta capacità di sintesi nei ruminanti delle lipoproteine di trasporto favorisce lo stoccaggio dei lipidi e, quando il tasso esterificazione degli acidi grassi che porta alla formazione di trigliceridi supera il tasso di deplezione, il fegato inizia a sviluppare un disordine metabolico detto lipidosi epatica (14,15).
In transizione, un eccessivo BEN può quindi portare allo sviluppo di patologie metaboliche come la chetosi e la steatosi epatica. Le concentrazioni ematiche di NEFA e dei CC, nello specifico di BHB, rispettivamente indici della mobilitazione lipidica nel preparto e dell’ossidazione degli acidi grassi non esterificati nel postparto, sono utilizzate come biomarker di patologie metaboliche (16). Il Gold Standard per la diagnosi di chetosi è rappresentato dalla concentrazione di BHB sierico; sono infatti stabiliti dei cut-off di BHB in base ai quali l’animale è considerato sano, subclinico o malato (17). La chetosi subclinica è una condizione non contraddistinta da sintomatologia, ma caratterizzata da valori sierici di CC superiori alla normale soglia fisiologica (18). Il valore limite del BHB, valutato nel post partum, presenta concentrazioni cut-off superiori a 1.0-1.2 mmol/L (19, 20). La chetosi clinica è invece caratterizzata sia da valori di BHB superiori a 2.9 mmol/L sia da segni e sintomi clinici evidenti (21).
La lipolisi comporta la variazione della concentrazione plasmatica degli FA; infatti, la quantità di acidi grassi totali nella prima fase di lattazione è maggiore della quantità di acidi grassi totali presente nelle successive fasi (medio-tardiva) e nel periodo di asciutta (22). La variazione delle concentrazioni plasmatiche degli FA, costituiti da un numero diverso di atomi di carbonio e da un numero differente di doppi legami, può essere utilizzata come nuovo biomarcatore di patologie metaboliche. Lo scopo della ricerca è quello di osservare la variazione nella composizione degli FA plasmatici nelle quattro classi lipidiche in bovine che mostravano valori di BHB differenti, al fine di valutare quali acidi grassi abbiano un significato predittivo per la diagnosi di iperchetonemia.
Variazioni delle concentrazioni degli acidi grassi plasmatici appartenenti a 4 classi lipidiche
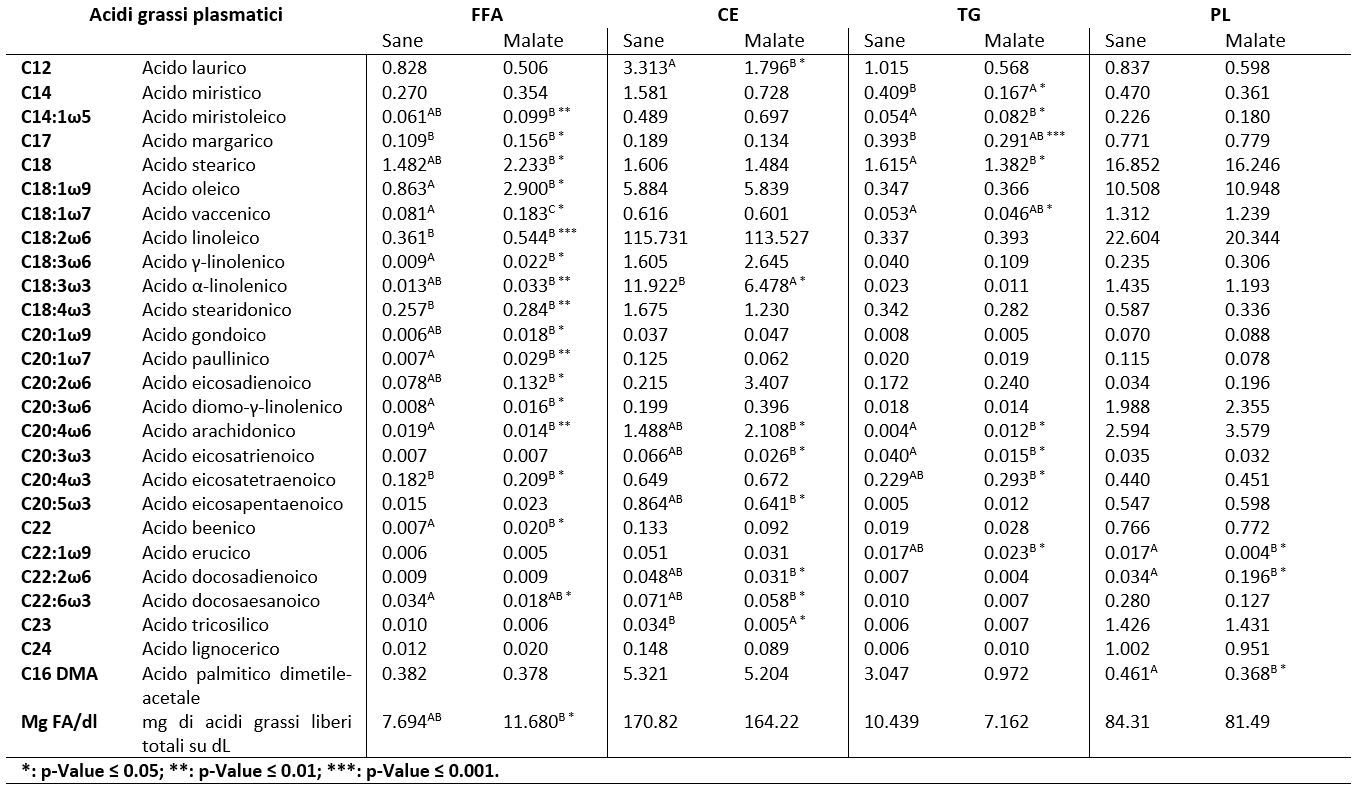
In tabella 1 sono riportate le concentrazioni medie degli acidi grassi costituenti le quattro differenti classi lipidiche plasmatiche suddivisi nei due gruppi di bovine (sane vs malate).
Gli FA derivanti dalle frazioni lipidiche degli esteri del colesterolo decrescono le loro concentrazioni plasmatiche all’aumentare del BHB ematico. Le concentrazioni dei CE dipendono dall’attività enzimatica della Lecithin Cholesterol Acyl-Transferase (LCAT), che trasferisce FA dalla lecitina al colesterolo producendo CE (23). I ruminanti presentano un decremento nell’immediato postparto di tale classe lipidica in quanto l’enzima LCAT, necessario alla formazione degli esteri del colesterolo, diminuisce la sua funzionalità del 19% in postparto, portando in tal modo al decremento dei CE plasmatici (24). Nakawaga e Kato (1998) affermano che bovine in chetosi hanno quantitativi ematici di LCAT e CE che decrescono in maggior misura rispetto ai quantitativi presenti in bovine sane (25). La minor presenza di FA derivanti dalla frazione lipidica degli esteri del colesterolo all’aumentare del BHB ematico è evidente nel nostro studio mediante la valutazione del quantitativo di FA totali in bovine in iperchetonemia (164.219 mg/dL) rispetto a bovine sane (170.815 mg/dL).
Gli FA appartenenti alla classe lipidica dei trigliceridi tendono a decrementare il quantitativo plasmatico all’incremento del BHB. La capacità del fegato di sintetizzare VLDL, costituite da elevate concentrazioni di trigliceridi, decresce all’aumentare del bilancio energetico negativo in quanto l’accumulo di lipidi a livello epatico influenza negativamente la funzionalità d’organo. È noto nella letteratura disponibile che esiste una correlazione negativa tra TG plasmatici e TG epatici (r = −0.30) (26). Il calo delle concentrazioni di TG nel sangue dopo il parto può indicare una bassa sintesi epatica e secrezione di VLDL a causa dell’accumulo di TG nel fegato (27). La somma degli acidi grassi derivanti dalla frazione lipidica dei TG risulta essere, nel nostro progetto, pari a 7.162 mg/dL in bovine malate rispetto ad un maggior quantitativo presente in bovine sane (10.439 mg/dL), questo a riprova del tendenziale decremento dei trigliceridi plasmatici.
Gli acidi grassi plasmatici, derivanti dalle frazioni lipidiche dei fosfolipidi decrementano all’aumentare del BHB ematico. Yamdagni e Schultz hanno dimostrato che nelle bovine da latte con presenza di iperchetonemia, i valori di PL diminuiscono del 38% (28). La concentrazione di proteina di trasferimento dei fosfolipidi (PLTP) è positivamente correlata con LCAT che diminuisce a livello ematico immediatamente dopo il parto quando negli epatociti vi è un eccessivo stoccaggio di trigliceridi (24).
In bovine in lattazione con bilancio energetico negativo, il processo catabolico, necessario al fine di ottenere energia per l’elevata produzione lattea, idrolizza i trigliceridi depositati nel tessuto adiposo generando un incremento degli acidi grassi liberi plasmatici (2). Nel nostro studio, infatti, la somma totale degli acidi grassi liberi plasmatici in bovine in chetosi risulta essere di 11.680 mg/dL, superiore al valore degli acidi grassi liberi presenti in bovine sane (7.694 md/dL).
Tabella 1.Valore medio delle concentrazioni degli acidi grassi significativi (±SD, mg/dL) relative alle classi lipidiche degli Acidi Grassi Liberi (FFA), Esteri del Colesterolo (CE), Fosfolipidi (PL) e Trigliceridi (TG) correlati a tre differenti valori di β-idrossibutirrato ematico.
Nel periodo di transizione, l’aumento della lipomobilizzazione influenza la mobilizzazione di acidi grassi con struttura biochimica differente (22). Il nostro progetto esamina la composizione chimica degli acidi grassi che variavano di concentrazione in relazione al cambiamento del BHB ematico. All’inizio della lattazione, quando il NEB e la lipomobilizzazione hanno la massima espressione, gli acidi grassi monoinsaturi (MUFA) presentano concentrazioni plasmatiche maggiori rispetto al periodo di asciutta o ad altre fasi della lattazione (media e tardiva) ove le concentrazioni tendono a decrementare (22). Anche nel nostro studio, C20:1ω7 e C14:1ω5, MUFA appartenenti alla classe lipidica degli FFA, hanno presentato un incremento delle concentrazioni tra bovine in normo stato di salute e bovine in iperchetonemia.
Gli acidi grassi che maggiormente diversificano la loro composizione sono gli acidi grassi a lunga catena (LCFA), ed in particolare gli acidi grassi polinsaturi (PUFA) della classe lipidica degli Omega 6 (PUFAω6) che incrementano il loro quantitativo nella fase media della lattazione (6). Dall’analisi statistica dei nostri dati, abbiamo evidenziato che la risposta ad un’elevata mobilizzazione del tessuto adiposo genera un incremento PUFAω6 della classe lipidica degli FFA (C20:2ω6, C18:2ω6, C18:3ω6 e C20:3ω6) (tabella 1).
I PUFA appartenenti alla famiglia degli omega 3 (PUFAω3) tendono a diminuire le concentrazioni plasmatiche dopo il parto, poiché vengono incorporati in misura maggiore dalla ghiandola mammaria quando il NEB è al massimo picco negativo (22). Anche nel nostro studio il C20:3ω3 (CE) presenta un andamento decrescente da bovine in buono stato di salute a bovine iperchetonemiche.
La concentrazione degli acidi grassi saturi (SFA) presenta un decremento del quantitativo plasmatico nell’intero periodo di lattazione rispetto alla fase di asciutta (22). Inoltre, bovine che sviluppano chetosi presentano concentrazioni di SFA inferiori rispetto a bovine con normo valore di BHB (29). Nel nostro progetto, tra gli acidi grassi con funzione predittiva ed aventi catena idrocarburica satura sono emersi il C12:0 (CE) ed il C14:0 (TG) che presentano un decremento delle concentrazioni da bovine sane a bovine iperchetonemiche (tabella 1).
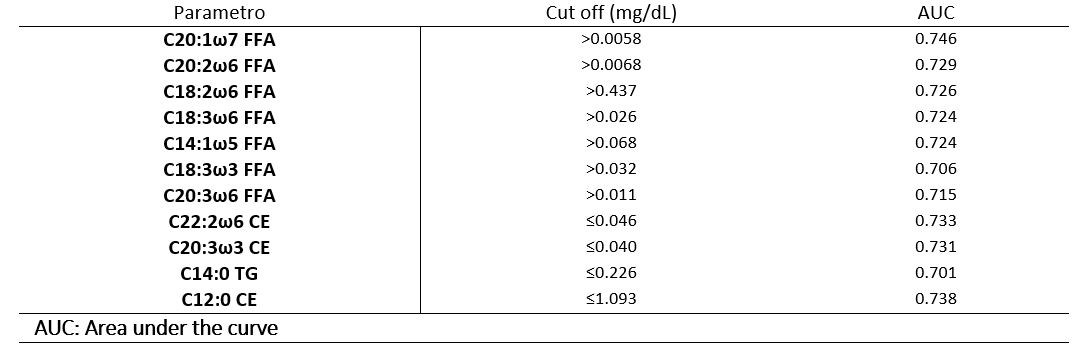
Mediante l’analisi della curva ROC, abbiamo stabilito il cut-off di ogni acido grasso predittivo per lo sviluppo di iperchetonemia. L’interpretazione della soglia critica dipende dall’area sottesa dalla curva (AUC), tale che se l’AUC> 0,70 il test eseguito è considerato moderatamente accettabile. Nella tabella 2 sono riportati, per ogni acido grasso avente funzione predittiva, i cut-off oltre il quale l’animale potrebbe essere a rischio di sviluppare patologie metaboliche.
Tabella 2. Limite soglia degli acidi grassi predittivi per lo sviluppo di iperchetonemia.
Dall’analisi dei dati, possiamo quindi affermare che esiste una correlazione tra la composizione degli acidi grassi plasmatici e le concentrazioni ematiche di BHB. I cut-off di specifici acidi grassi individuati mediante la ricerca potrebbero quindi essere utilizzati come nuovi biomarcatori di chetosi.
Autori: Rossella Tessari, Matteo Gianesella, Massimo Morgante ed Enrico Fiore, Dipartimento di Medicina Animale, Produzioni e Salute (MAPS), Università degli studi di Padova.
Sinossi tratta da “Changes of Plasma Fatty Acids in Four Lipid Classes to Understand Energy Metabolism at Different Levels of Non-Esterified Fatty Acid (NEFA) in Dairy Cows“, Animals 2020, 10(8), 1410; doi.org/10.3390/ani10081410.
Bibliografia
- Grummer, R.R. Impact of changes in organic nutrient metabolism on feeding the transition dairy cow. J. Anim. Sci. 1995, 73, 2820–2833.
- Block, E. Transition cow research—What makes sense today? In Proceedings of the High Plains Dairy Conference, Amarillo, TX, USA, 10–12 March 2010; pp. 75–98.
- Kim, I.H.; Suh, G.H. Effect of the amount of body condition loss from the dry to near calving periods on the subsequent body condition change, occurrence of postpartum diseases, metabolic parameters and reproductive performance in Holstein dairy cows. Theriogenology. 2003, 60, 1445–1456.
- Large, V.; Peroni, O.; Letexier, D.; Ray, H.; Beylot, M. Metabolism of lipids in human white adipocyte 1. Diabetes Metab. 2004, 30, 294–309.
- De Koster, J.; Nelli, R.K.; Strieder-Barboza, C.; de Souza, J.; Lock, A.L.; Contreras, G.A. The contribution of hormone sensitive lipase to adipose tissue lipolysis and its regulation by insulin in periparturient dairy cows. Sci. Rep. 2018, 8, 1–11.
- Douglas, G.N.; Rehage, J.; Beaulieu, A.D.; Bahaa, A.O.; Drackley, J.K. Prepartum nutrition alters fatty acid composition in plasma, adipose tissue, and liver lipids of periparturient dairy cows. J. Dairy Sci. 2007, 90, 2941–2959.
- Demeyer, D.; Doreau, M. Targets and Procedures for Altering Ruminant Meat and Milk Lipids. Proc Nutr Soc. 1999, 58, 593–607.
- Contreras, G.A.; O’Boyle, N.J.; Herdt, T.H.; Sordillo, L.M. Lipomobilization in periparturient dairy cows influences the composition of plasma nonesterified fatty acids and leukocyte phospholipid fatty acids. J. Dairy Sci. 2010, 93, 2508–2516.
- McArt, J.A.A.; Nydam, D.V.; Oetzel, G.R. Dry period and parturient predictors of early lactation hyperketonemia in dairy cattle. J. Dairy Sci. 2013, 96, 198–209.
- Fantini, A. Chetosi Metabolica. SUMMA. 2016, 5, 13–21.
- Hillreiner, M.; Flinspach, C.; Pfaffl, M.W.; Kliem, H. Effect of the ketone body beta-hydroxybutyrate on the innate defense capability of primary bovine mammary epithelial cells. PLoS ONE 2016, 11, e0157774.
- Nelson, D.L.; Cox, M.M. I principi di biochimica di Lehninger, 5th edition, Milano, Zanichelli. 2008, pp. 651-677
- Oikawa, S.; Mizunuma, Y.; Iwasaki, Y.; Tharwat, M. Changes of very low-density lipoprotein concentration in hepatic blood from cows with fasting-induced hepatic lipidosis. Can. J. Vet. Res. 2010, 74, 317–320.
- Bertics, S.J.; Grummer, R.R.; Cadorniga-Valino, C.; Stoddard, E.E. Effect of Prepartum Dry Matter Intake on Liver Triglyceride Concentration and Early Lactation. J. Dairy Sci. 1992, 75, 1914–1922.
- Jorritsma, R.; Jorritsma, H.; Schukken, Y.H.; Bartlett, P.C.; Wensing Th.; Wentink, G.H., Prevalence and indicators of post partum fatty infiltration of the liver in nine commercial dairy herds in The Netherlands. Livest Prod Sci. 2001, 68, 53–60.
- Herdt, T.H. Ruminant adaptation to negative energy balance. Vet. Clin. N. Am. Food Anim. Pract. 2000, 16, 215–230.
- Iwersen, M.; Falkenberg, U.; Voigtsberger, R.; Forderung, D.; Heuwieser, W. Evaluation of an Electronic Cowside Test to Detect Subclinical Ketosis in Dairy Cows. Journal of Dairy Science 2009, 92, 2618–2624.
- Andersson, L. Subclinical Ketosis in Dairy Cows. The Veterinary Clinics of North America. Food Animal Practice. 1988, 4, 233–251.
- Ospina, P.A.; Nydam, D.V.; Stokol, T.; Overton, T.R. Evaluation of nonesterified fatty acids and β-hydroxybutyrate in transition dairy cattle in the northeastern United States: Critical thresholds for prediction of clinical diseases. J. Dairy Sci. 2010, 93, 546–554.
- Duffield, T. Subclinical ketosis in lactating dairy cattle. Vet. Clin. N. Am. Food Anim. 2000, 16, 231–253.
- Oetzel, G.R. Monitoring and testing dairy herds for metabolic disease. Vet. Clin. N. Am. Food Anim. 2004, 20, 651–674.
- Abdel-Raheem, S.; Schreiner, M.; Iben, C. Lactational and seasonal variations in plasma fatty acids profiles in dairy cows. Wien. Tierarrztl. Monatsschr. 2010, 97, 149–156.
- Pösö, A.R.; Saukko, T.M.; Tesfa, A.T.; Lindberg, L. Fat infiltration in liver and activity of lecithin: Cholesterol acyltransferase in serum of dry and lactating dairy cows. Res. Vet. Sci. 2000, 68, 169–173.
- Van Den Top, A.M.; Van Tol, A.; Jansen, H.; Geelen, M.J.H.; Beynen, A.C. Fatty liver in dairy cows post-partum is associated with decreased concentration of plasma triacylglycerols and decreased activity of lipoprotein lipase in adipocytes. J. Dairy Res. 2005, 72, 129–137.
- Nakagawa, H.; Katoh, N. Reduced activity of lecithin: Cholesterol acyltransferase in the serum of cows with ketosis and left displacement of the abomasum. Vet. Res. Commun. 1998, 22, 517–524.
- Batista, C.P.; Castro, S.M.; Correa, H.J.; Gonçalves, R.S.; de Faria Vale, S.; González, F. Relation between liver lipid content and plasma biochemical indicators in dairy cows. Acta Sci. Vet. 2020, 48, 1–9.
- Murondoti, A.; Jorritsma, R.; Beynen, C.; Wensing, T.; Geelen, M.J.H. Unrestricted feed intake during the dry period impairs the postpartum oxidation and synthesis of fatty acids in the liver of dairy cows. J. Dairy Sci. 2004, 87, 672–679.
- Yamdagni, S.; Schultz, L.H. Fatty acid composition of blood plasma lipids of normal and ketotic cows. J. Dairy Sci. 1970, 53, 1046–1050.
- Liu, L.; Shen, T.; Yang, W.; Yu, H.; Gao, S.; Huang, B.; Xu, C. Ketotic cows display a different serum nonesterified fatty acid composition. J. Dairy Res. 2020, 87, 52–55.